|
–Р—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є –њ–Њ—А–∞–ґ–∞—О—В 5-7% –љ–∞—Б–µ–ї–µ–љ–Є—П –Ј–µ–Љ–љ–Њ–≥–Њ —И–∞—А–∞, —З–∞—И–µ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П —Г –ґ–µ–љ—Й–Є–љ, —З–µ–Љ —Г –Љ—Г–ґ—З–Є–љ, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤ –Љ–Њ–ї–Њ–і–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ. –Р—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –њ–Њ—П–≤–ї—П—О—В—Б—П –∞–љ—В–Є—В–µ–ї–∞ (–Р–ђ) –Є–ї–Є –Ї–ї–Њ–љ—Л –Ґ-–Ї–ї–µ—В–Њ–Ї, —Б–њ–Њ—Б–Њ–±–љ—Л–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Њ–≤–∞—В—М —Б —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–Љ–Є –∞–љ—В–Є–≥–µ–љ–∞–Љ–Є (Ag) –Є —В–µ–Љ —Б–∞–Љ—Л–Љ —А–∞–Ј—А—Г—И–∞—В—М –Ї–ї–µ—В–Ї–Є –Є —В–Ї–∞–љ–Є, –Њ–±–ї–∞–і–∞—О—Й–Є–µ —Н—В–Є–Љ–Є –∞–љ—В–Є–≥–µ–љ–∞–Љ–Є. –Т–Њ–Ј–љ–Є–Ї—И–Є–є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б - —П–≤–ї–µ–љ–Є–µ –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–µ, –њ—А–Є–≤–Њ–і—П—Й–µ–µ –Ї –і–Њ–ї–≥–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ—Г –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—О —В–Ї–∞–љ–µ–є. –°–≤—П–Ј–∞–љ–Њ —Н—В–Њ, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М, —Б —В–µ–Љ, —З—В–Њ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –њ–Њ—Б—В–Њ—П–љ–љ–Њ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–µ—В—Б—П —В–Ї–∞–љ–µ–≤—Л–Љ–Є –∞–љ—В–Є–≥–µ–љ–∞–Љ–Є. –Т –Ї–∞—З–µ—Б—В–≤–µ –∞—Г—В–Њ–∞–љ—В–Є–≥–µ–љ–Њ–≤ –Љ–Њ–≥—Г—В –≤—Л—Б—В—Г–њ–∞—В—М –±–µ–ї–Ї–Є, –љ—Г–Ї–ї–µ–Є–љ–Њ–≤—Л–µ –Ї–Є—Б–ї–Њ—В—Л, —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і—Л, —Б–∞—Е–∞—А–∞, —Б—В–µ—А–Њ–Є–і—Л –Є —В.–і.
 
–Ь–µ—Е–∞–љ–Є–Ј–Љ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ —А–∞–Ј—А—Г—И–µ–љ–Є—П –Ї–ї–µ—В–Њ–Ї –Є —В–Ї–∞–љ–µ–є –љ–µ –Њ—В–ї–Є—З–Є–Љ –Њ—В —В–Њ–≥–Њ, –Ї–Њ—В–Њ—А—Л–є –і–µ–є—Б—В–≤—Г–µ—В –≤ —Г—Б–ї–Њ–≤–Є—П—Е –љ–Њ—А–Љ—Л –њ—А–Є –∞–і–∞–њ—В–Є–≤–љ–Њ–Љ –Є–Љ–Љ—Г–љ–Є—В–µ—В–µ, –Є –≤–Ї–ї—О—З–∞–µ—В –Ї–∞–Ї —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –Р–ђ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–ї–∞—Б—Б–Њ–≤, —В–∞–Ї –Є —Б—Г–±–њ–Њ–њ—Г–ї—П—Ж–Є–Є –Ґ-–Ї–ї–µ—В–Њ–Ї, —Б–њ–Њ—Б–Њ–±–љ—Л—Е —А–µ–∞–≥–Є—А–Њ–≤–∞—В—М –љ–∞ —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–µ Ag. –Ю–±–љ–∞—А—Г–ґ–µ–љ–Є–µ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —А–∞–Ј–ї–Є—З–љ—Л—Е–∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Є–Љ–µ–µ—В –њ–Њ—А–Њ–є —А–µ—И–∞—О—Й–µ–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П —В–Њ–≥–Њ –Є–ї–Є –Є–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —В–µ—Б–љ–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –±–Њ–ї–µ–Ј–љ–Є –Є–ї–Є –Љ–Њ–ґ–µ—В –њ—А–µ–і—И–µ—Б—В–≤–Њ–≤–∞—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Њ—З–µ–≤–Є–і–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –Њ–њ—А–µ–і–µ–ї—П—В—М –њ—А–Њ–≥–љ–Њ–Ј.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є
–Ф–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Љ–∞—А–Ї–µ—А–∞–Љ–Є –±–Њ–ї–µ–Ј–љ–µ–є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —П–≤–ї—П—О—В—Б—П –∞–љ—В–Є—П–і–µ—А–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞ (–Р–ѓ–Р). –Э–∞–ї–Є—З–Є–µ –Р–ѓ–Р –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ —Б —В–∞–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –Ї–∞–Ї —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В (–†–Р), —Б–Є—Б—В–µ–Љ–љ–∞—П –Ї—А–∞—Б–љ–∞—П –≤–Њ–ї—З–∞–љ–Ї–∞ (–°–Ъ–Т), —Б–Љ–µ—И–∞–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–Њ–µ–і–Є-–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є (–°–Ч–°–Ґ), —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–∞, —Б–Є–љ–і—А–Њ–Љ –®–µ–≥—А–µ–љ–∞ (–°–®), –і–µ—А–Љ–∞—В–Њ–Ј—Л, –њ–Њ–ї–Є–Љ–Є–Њ–Ј–Є—В—Л, –і–Є—Б–Ї–Њ–Є–і-–љ–∞—П –Ї—А–∞—Б–љ–∞—П –≤–Њ–ї—З–∞–љ–Ї–∞ –Є —Б –і—А—Г–≥–Є–Љ–Є –њ–ї–Њ—Е–Њ –Є–Ј—Г—З–µ–љ–љ—Л–Љ–Є —Б–Є–љ–і—А–Њ–Љ–∞–Љ–Є, –љ–∞–њ—А–Є–Љ–µ—А, —Б CREST-—Б–Є–љ–і—А–Њ–Љ –Њ–Љ (—А–∞–Ј–љ–Њ–≤–Є–і–љ–Њ—Б—В—М —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є–Є –≤ –≤–Є–і–µ –Ї–∞–ї—М—Ж–Є–љ–Њ–Ј–∞, —Б–Є–љ–і—А–Њ–Љ–∞ –†–µ–є–љ–Њ, –і–Є—Б–Ї–Є–љ–µ–Ј–Є–Є –њ–Є—Й–µ–≤–Њ–і–∞, —Б–Ї–ї–µ—А–Њ- –і–∞–Ї—В–Є–ї–Є–Є –Є —В–µ–ї–µ–∞–љ–≥–Є—Н–Ї—В–∞–Ј–Є–Є) –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–Љ —Б–Є—Б—В–µ–Љ–љ—Л–Љ —Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ (–Я–°–°). –°–Ъ–Т - —Н—В–Њ –њ—А–Њ—В–Њ—В–Є–њ –Њ–±—Й–Є—Е –Є–ї–Є —Б–Є—Б—В–µ–Љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е—Б—П –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ–Љ –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –∞–љ—В–Є—В–µ–ї –Ї –Љ–љ–Њ–ґ–µ—Б—В–≤—Г —Б–Њ–±—Б—В–≤–µ–љ–љ—Л—Е –∞–љ—В–Є–≥–µ–љ–Њ–≤. –І–∞—Б—В–Њ—В–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є –љ–∞ –Р–ѓ–Р —Б—А–µ–і–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –њ—А–Є–Љ–µ—А–љ–Њ 2-4%. –Р–ѓ–Р –≤—Л—П–≤–ї—П—О—В—Б—П –≤ 93% —Б–ї—Г—З–∞–µ–≤ –њ—А–Є –°–Ъ–Т, –≤ 60% - –њ—А–Є –°–®, –≤ 99% - –њ—А–Є –°–Ч–°–Ґ, –≤ 40% - –њ—А–Є –†–Р –Є 15% —Б–ї—Г—З–∞–µ–≤ –њ—А–Є –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤–Њ–є —Д–Њ—А–Љ–µ –†–Р.
–Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П –Є–і–µ–љ—В–Є—Д–Є–Ї–∞—Ж–Є—П –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Ї —П–і–µ—А–љ—Л–Љ –Є —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ –∞–љ—В–Є–≥–µ–љ–∞–Љ, —В–∞–Ї–Є–Љ –Ї–∞–Ї RNP-70 (–±–µ–ї–Ї—Г —Б –Љ–Њ–ї.–Љ–∞—Б—Б–Њ–є 70 kDaUI-snRNP-–Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞), RNP/Sm, Sm, SS-A(52 –Є 60 kDa), SS-B, Scl- 70, —Ж–µ–љ—В—А–Њ–Љ–µ—А–µB, Jo-1 –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є–є.
вАҐ –Р—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞ –Ї –Ф–Э–Ъ –Є –≥–Є—Б—В–Њ–љ–∞–Љ
–Р—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞ –Љ–Њ–≥—Г—В –≤—Л—А–∞–±–∞—В—Л–≤–∞—В—М—Б—П –Є–ї–Є –Ї –і–≤—Г—Е—Ж–µ–њ–Њ—З–µ—З–љ–Њ–є –Ф–Э–Ъ(dsDNA),–Є–ї–Є –Ї –Њ–і–љ–Њ—Ж–µ–њ–Њ—З–µ—З–љ–Њ–є –Ф–Э–Ъ(ssDNA).–Р–љ—В–Є—В–µ–ї–∞, —А–∞—Б–њ–Њ–Ј–љ–∞—О—Й–Є–µ –љ—Г–Ї–ї–µ–Њ—В–Є–і–љ—Л–µ –Њ—Б–љ–Њ–≤–∞–љ–Є—П ssDNA, —П–≤–ї—П—О—В—Б—П –≥–ї–∞–≤–љ—Л–Љ–Є —Б–Њ-—Б—В–∞–≤–ї—П—О—Й–Є–Љ–Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –∞–љ—В–Є-—П–і–µ—А–љ—Л—Е –Р–ђ. –≠—В–Є –∞–љ—В–Є—В–µ–ї–∞ –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–љ—Л –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –Њ–њ—А–µ–і–µ-–ї—С–љ–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ, –њ—А–Є—Б—Г—В—Б—В–≤—Г—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –њ—А–Є –°–Ъ–Т, —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є, —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–Љ –∞—А—В—А–Є—В–µ, —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є–Є –Є —Б–Є–љ–і—А–Њ–Љ–µ –®–µ–≥—А–µ–љ–∞. –Р—Г—В–Њ-–Р–ђ –Ї dsDNA–Є–Љ–µ—О—В –Љ–µ–љ–µ–µ –Њ–±—Й–Є–є —Е–∞—А–∞–Ї—В–µ—А –Є –њ–Њ—П–≤–ї—П—О—В—Б—П, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ, –њ—А–Є –°–Ъ–Т, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –њ—А–µ–Њ–±–ї–∞–і–∞—О—В Ab–Ї–ї–∞—Б—Б–∞ G. –Ґ–Є—В—А –∞—Г—В–Њ-Ab–Ї dsDNA—Б–≤—П–Ј–∞–љ —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —В–Њ—З–љ–Њ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –∞–љ—В–Є-dsDNA–Є –∞–љ—В–Є—В–µ–ї –Ї –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Г Sm–≤–∞–ґ–љ–Њ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т. –Я—А–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –Є —Г—Б–њ–µ—И–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –∞–љ—В–Є—В–µ–ї –Ї dsDNA–Є –Ї ssDNA–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П. –Х–ґ–µ–Љ–µ—Б—П—З–љ—Л–є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ –Є—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –Ї—А–Њ–≤–Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–µ–і—Б–Ї–∞–Ј–∞—В—М –љ–∞–і–≤–Є–≥–∞—О—Й–Є–є—Б—П —А–µ—Ж–Є–і–Є–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ –∞–≥—А–µ—Б—Б–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П —Г–ї—Г—З—И–∞–µ—В –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј. –Э–∞–њ—А–Њ—В–Є–≤, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –∞–љ—В–Є—В–µ–ї –Ї –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Г Sm–љ–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П –њ—А–Є —В–µ—А–∞–њ–Є–Є –°–Ъ–Т. –Ь–Њ–љ–Є—В–Њ—А–Є–љ–≥ –љ–µ –Є–Љ–µ–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П. –Т–∞–ґ–љ–Њ—Б—В—М –≤—Л—П–≤–ї–µ–љ–Є—П –∞–љ—В–Є—В–µ–ї –Ї –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Г Sm–њ—А–Є –°–Ъ–Т –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –Є—Е –∞–±—Б–Њ–ї—О—В–љ–Њ–є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О –њ—А–Є —Н—В–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є. –Ґ–Њ–ї—М–Ї–Њ –≤ —А–µ–і–Ї–Є—Е —Б–ї—Г—З–∞—П—Е –∞–љ—В–Є—В–µ–ї–∞ –Ї –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Г Sm–Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ –Є –Њ–±—Л—З–љ–Њ –≤—Л—П–≤–ї—П—О—В—Б—П –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –∞–љ—В–Є—В–µ–ї–∞–Љ–Є –Ї RNP/Sm- –Ї–Њ–Љ–њ–ї–µ–Ї—Б—Г. –Э–µ–≥–∞—В–Є–≤–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –∞–љ—В–Є-Sm–љ–µ –Є—Б–Ї–ї—О—З–∞—О—В –љ–∞–ї–Є—З–Є—П –°–Ъ–Т. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є, —Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є —Б –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ–Љ Sm-–∞–љ—В–Є—В–µ–ї, —П–≤–ї—П—О—В—Б—П, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, –±–Њ–ї–µ–µ –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–µ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ–Њ—А–∞–ґ–µ–љ–Є–µ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–µ –њ—Б–Є—Е–Њ–Ј—Л –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–∞—П —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В—М —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї.
–Я—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ 80% –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т –Є–Љ–µ–ї–Є –∞–љ—В–Є—В–µ–ї–∞ –Ї –≥–Є—Б—В–Њ–љ–∞–Љ. –Ю—З–µ–љ—М —З–∞—Б—В–Њ —Н—В–Є –∞–љ—В–Є—В–µ–ї–∞ –Њ–±-–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Њ–є (–Ы–Ъ–Т) –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ —В–∞–Ї–Є—Е –ї–µ–Ї–∞—А—Б—В–≤, –Ї–∞–Ї –≥–Є–і—А–∞–ї–∞–Ј–Є–љ –Є –њ—А–Њ–Ї–∞–Є–љ–∞–Љ–Є–і. –Ю–і–љ–∞–Ї–Њ –∞–љ—В–Є-dsDNA–Њ—В—Б—Г—В—Б—В–≤—Г—О—В. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –∞–љ—В–Є-dsDNA–Є –∞–љ—В–Є—В–µ–ї –Ї –≥–Є—Б—В–Њ–љ–∞–Љ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г –°–Ъ–Т –Є –Ы–Ъ–Т. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –∞–љ—В–Є—В–µ–ї–∞ –Ї –≥–Є—Б—В–Њ–љ–∞–Љ –Љ–Њ–ґ–љ–Њ –Њ–±–љ–∞—А—Г–ґ–Є—В—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–µ—А–≤–Є—З–љ—Л–Љ –±–Є-–ї–Є–∞—А–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ, –†–Р –Є —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є–µ–є.
вАҐ –Р–љ—В–Є—В–µ–ї–∞ –Ї –љ—Г–Ї–ї–µ–Њ—Б–Њ–Љ–∞–Љ
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –°–Ъ–Т –њ–Њ—П–≤–Є–ї—Б—П –љ–Њ–≤—Л–є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Љ–∞—А–Ї–µ—А - –∞–љ—В–Є—В–µ–ї–∞ –Ї –љ—Г–Ї-–ї–µ–Њ—Б–Њ–Љ–∞–Љ. –Р–љ—В–Є—В–µ–ї–∞ –Ї –љ—Г–Ї–ї–µ–Њ—Б–Њ–Љ–∞–Љ –њ–Њ—П–≤–ї—П—О—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–∞–љ—М—И–µ, —З–µ–Љ –∞–љ—В–Є—В–µ–ї–∞ –Ї dsDNA–Є –Њ–±-–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П —Г 84-88% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ъ–Т. –Э—Г–Ї–ї–µ–Њ—Б–Њ–Љ–∞ —Б–Њ—Б—В–Њ–Є—В –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –Є–Ј 140 –њ–∞—А –Њ—Б–љ–Њ–≤–∞–љ–Є–є –Ф–Э–Ъ, –Њ–±–µ—А–љ—Г—В–Њ–є –≤–Њ–Ї—А—Г–≥ —П–і—А–∞ –Є–Ј –±–µ–ї–Ї–Њ–≤-–≥–Є—Б—В–Њ–љ–Њ–≤ –Э2–Р, –Э2–Т, –Э–Ч –Є –Э4. –У–Є—Б—В–Њ–љ –Э1 –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В —Б –љ—Г–Ї–ї–µ–Њ—Б–Њ–Љ–Њ–є –Є –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ —Б –Ф–Э–Ъ —Б–≤—П–Ј—Л–≤–∞–µ—В –њ—А–Є–ї–µ–≥–∞—О—Й–Є–µ –љ—Г–Ї–ї–µ–Њ—Б–Њ–Љ—Л. –Ю—В—Б—О–і–∞ –Љ–Њ–ґ–љ–Њ –Ј–∞–Ї–ї—О—З–Є—В—М, —З—В–Њ –љ—Г–Ї–ї–µ–Њ—Б–Њ–Љ–љ–∞—П —Б—В—А—Г–Ї—В—Г—А–∞ - –≤–∞–ґ–љ–µ–є—И–∞—П –≤ —Б–ґ–∞—В–Є–Є —П–і–µ—А–љ–Њ–є –Ф–Э–Ъ. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ 16-30% –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т –Є–Љ–µ–ї–Є –∞–љ—В–Є—В–µ–ї–∞ –Ї –љ—Г–Ї–ї–µ–Њ—Б–Њ–Љ–µ, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –∞–љ—В–Є-dsDNA–Є –∞–љ—В–Є—В–µ–ї–∞ –Ї –≥–Є—Б—В–Њ–љ–∞–Љ —Г —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є. –Р–љ—В–Є–љ—Г–Ї–ї–µ–Њ—Б–Њ–Љ–љ—Л–µlgG-–∞–љ—В–Є—В–µ–ї–∞ - –±–Њ–ї–µ–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–є –Љ–∞—А–Ї–µ—А –°–Ъ–Т, —З–µ–Љ –∞–љ—В–Є—В–µ–ї–∞ –Ї –і–≤—Г—Б–њ–Є—А–∞–ї—М–љ–Њ–є –Ф–Э–Ъ, –Є –Є—Е –љ–∞—Е–Њ–і—П—В –њ–Њ—З—В–Є –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –њ—А–Є –°–Ъ–Т, —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є–Є –Є —Б–Љ–µ—И–∞–љ–љ–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є (–°–Ч–°–Ґ). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ–і–∞–≤–љ–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–Њ, —З—В–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б—Л –∞–љ—В–Є—П–і–µ—А–љ—Л—Е –∞–љ—В–Є—В–µ–ї —Б –љ—Г–Ї–ї–µ–Њ—Б–Њ–Љ–∞–Љ–Є –Љ–Њ–≥—Г—В —Б–≤—П–Ј—Л–≤–∞—В—М –≥–µ–њ–∞—А–∞–љ-—Б—Г–ї—М—Д–∞—В –≥–ї–Њ–Љ–µ—А—Г–ї—П—А–љ–Њ–є –±–∞–Ј–∞–ї—М–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л —З–µ—А–µ–Ј –≥–Є—Б—В–Њ–љ–Њ–≤—Г—О —З–∞—Б—В—М –љ—Г–Ї–ї–µ–Њ—Б–Њ–Љ—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ъ–Т.
вАҐ –Р—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞ –Ї —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ
–Т—Л–і–µ–ї–µ–љ–Є–µ –≤ —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ—Г—О –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –≥—А—Г–њ–њ—Г —Б–Љ–µ—И–∞–љ–љ–Њ–≥–Њ —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ—В–Ї–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—Б–љ–Њ–≤–∞–љ–Њ –љ–∞ –≤—Л—П–≤–ї–µ–љ–Є–Є —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є—Е –∞–љ—В–Є—В–µ–ї –Ї RNP-70. –Ю–і–љ–∞–Ї–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –њ—А–Є–Ј–љ–∞—О—В, —З—В–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –∞–љ—В–Є—В–µ–ї–∞–Љ–Є RNP-70 –Њ–±—Л—З–љ–Њ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А—П—О—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–Љ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Њ–љ–љ—Л–Љ –Ї—А–Є—В–µ—А–Є—П–Љ –°–Ъ–Т, –Њ–і–љ–∞–Ї–Њ —Г –љ–Є—Е –љ–∞–±–ї—О–і–∞—О—В—Б—П —Б–≤–Њ–µ–Њ–±—А–∞–Ј–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Д–Њ—А–Љ—Л –µ–µ —В–µ—З–µ–љ–Є—П. –Я–Њ –≤—Б–µ–є –≤–Є–і–Є–Љ–Њ—Б—В–Є, –°–Ч–°–Ґ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є —Н—В–∞–њ –≤ —А–∞–Ј–≤–Є—В–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ–Њ—Б–ї–µ —З–µ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —В—А–∞–љ—Б—Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П –≤ –Ї–Њ–љ–Ї—А–µ—В–љ—Г—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О —Д–Њ—А–Љ—Г - –°–Ъ–Т, —Б–Є—Б—В–µ–Љ–љ—Л–є —Б–Ї–ї–µ—А–Њ–Ј, —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В, –њ–Њ–ї–Є–Љ–Є–Њ–Ј–Є—В.
–Р—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞ –Ї —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ SS-A–Є SS-–Т –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–µ—А–≤–Є—З–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –®–µ–≥—А–µ–љ–∞. –°–Є–љ–і—А–Њ–Љ –®–µ–≥—А–µ–љ–∞ —П–≤–ї—П–µ—В—Б—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ, –њ–Њ—А–∞–ґ–∞—О—Й–µ–Љ —Б–ї—О–љ–љ—Л–µ –Є —Б–ї–µ–Ј–љ—Л–µ –ґ–µ–ї–µ–Ј—Л, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Ї—Б–µ—А–Њ—Б—В–Њ–Љ–Є–Є –Є –Ї—Б–µ—А–Њ—Д—В–∞–ї—М–Љ–Є–Є. –Ю–±–љ–∞—А—Г–ґ–µ–љ–Є–µ —Г –±–Њ–ї—М–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –®–µ–≥—А–µ–љ–∞ –∞–љ—В–Є—В–µ–ї –Ї SS-A–Є SS-–Т –Љ–Њ–ґ–µ—В –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ —В–∞–Ї–Є—Е —Н–Ї—Б—В—А–∞–≥–ї–∞–љ–і—Г–ї—П—А–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Ї–∞–Ї –≤–∞—Б–Ї—Г–ї–Є—В, –ї–Є–Љ—Д–Њ–∞–і–µ–љ–Њ–њ–∞—В–Є—П, —Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є—П, –∞–љ–µ–Љ–Є—П –Є –ї–µ–є–Ї–Њ–њ–µ–љ–Є—П. –Р–љ—В–Є—В–µ–ї–∞ –Ї SS-A–Њ–±—Л—З–љ–Њ –≤—Б—В—А–µ—З–∞—О—В—Б—П –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Њ–є —Д–Њ—В–Њ—Б–µ–љ—Б–Є—В–Є–≤–љ—Л—Е –Ї–Њ–ґ–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є.
–С–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –∞–љ—В–Є—В–µ–ї –Ї –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Г SS-A—Г –ґ–µ–љ—Й–Є–љ –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Ї–∞–Ї —Д–∞–Ї—В–Њ—А–∞ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —В—П–ґ–µ–ї–Њ–є –Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Г –њ–ї–Њ–і–∞. –Э–µ–Њ–љ–∞—В–∞–ї—М–љ—Л–є –≤–Њ–ї—З–∞–љ–Њ—З-–љ—Л–є —Б–Є–љ–і—А–Њ–Љ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Г –љ–Њ–≤–Њ—А–Њ–ґ–і—С–љ–љ—Л—Е –Њ—В 5-10% –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ, –Є–Љ–µ—О—Й–Є—Е –≤—Л—Б–Њ–Ї–Є–є —В–Є—В—А –∞–љ—В–Є-SS-A. –Р–љ—В–Є—В–µ–ї–∞ –Ї –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Г SS-–Т –њ–Њ—П–≤–ї—П—О—В—Б—П —А–µ–і–Ї–Њ –Є —В–Њ–ї—М–Ї–Њ –≤–Љ–µ—Б—В–µ —Б –∞–љ—В–Є—В–µ–ї–∞–Љ–Є –Ї SS-A. –Ю—Б–љ–Њ–≤–љ—Л–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Є —П–≤–ї—П–µ—В—Б—П –і–µ—А–Љ–∞—В–Њ–Ј –Є —А—П–і —Б–Є—Б—В–µ–Љ–љ—Л—Е –Є –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Є–љ–і—А–Њ–Љ–Њ–≤, –≤–Ї–ї—О—З–∞—О—Й–Є—Е –≤—А–Њ–ґ–і–µ–љ–љ—Г—О –њ–Њ–њ–µ—А–µ—З–љ—Г—О –±–ї–Њ–Ї–∞–і—Г, –≥–µ–њ–∞—В–Є—В, –≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї—Г—О –∞–љ–µ–Љ–Є—О –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—О. –Т—Б–µ –±–µ—А–µ–Љ–µ–љ–љ—Л–µ —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –°–Ч–°–Ґ –і–Њ–ї–ґ–љ—Л –±—Л—В—М –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ—Л –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –≥—А—Г–њ–њ—Л —А–Є—Б–Ї–∞ –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Є.
–Я—А–Є —Б–Є—Б—В–µ–Љ–љ–Њ–є —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є–Є –Є–Љ–µ—О—В –Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є—В–µ–ї–∞ –Ї —Ж–µ–љ—В—А–Њ–Љ–µ—А–µ –Т –Є —В–Њ–њ–Њ–Є–Ј–Њ–Љ–µ—А–∞–Ј–µl (Scl-70), –Ї–∞–Ї –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –ї–Є–Љ–Є—В–Є—А–Њ–≤–∞–љ–љ–Њ–є –Є –і–Є—Д—Д—Г–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ–љ–Њ–є —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Р—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞ –Ї Jo-1 –∞–љ—В–Є–≥–µ–љ—Г –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–ї–Є–Љ–Є–Њ–Ј–Є—В–∞–Љ–Є –Є –і–µ—А-–Љ–∞—В–Њ–Љ–Є–Њ–Ј–Є—В–∞–Љ–Є.
вАҐ –†–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є —Д–∞–Ї—В–Њ—А (–†–§)
–†–§ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В –њ—А–Є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–Љ –∞—А—В—А–Є—В–µ - –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ–є –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–є —Д–Њ—А–Љ–µ —Е—А–Њ-–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П —Б—Г—Б—В–∞–≤–Њ–≤ (—Б–Є–љ–Њ–≤–Є—В). 75-80% –±–Њ–ї—М–љ—Л—Е —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ –Є–Љ–µ—О—В –†–§. –Ю–і–љ–∞–Ї–Њ –†–§ —В–∞–Ї–ґ–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В –њ—А–Є —Б–Є–љ–і—А–Њ–Љ–µ –®–µ–≥—А–µ–љ–∞, —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є–Є, –і–µ—А–Љ–∞—В–Њ–Љ–Є–Њ–Ј–Є—В–µ, –≥–Є–њ–µ—А–≥–ї–Њ-–±—Г–ї–Є–љ–µ–Љ–Є—П—Е, –Т-–Ї–ї–µ—В–Њ—З–љ—Л—Е –ї–Є–Љ—Д–Њ–њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е. –Я–Њ —Б–≤–Њ–µ–є –њ—А–Є—А–Њ–і–µ –†–§ - —Н—В–Њ –∞–љ—В–Є—В–µ–ї–∞ –њ—А–Њ—В–Є–≤ Fc-—Д—А–∞–≥–Љ–µ–љ—В–Њ–≤ lgG. –І–∞—Й–µ (–і–Њ 90% —Б–ї—Г—З–∞–µ–≤) —Н—В–Є –∞–љ—В–Є—В–µ–ї–∞ –Њ—В–љ–Њ—Б—П—В—Б—П –Ї lgM, –љ–Њ –≤—Б—В—А–µ—З–∞—О—В—Б—П –Є lgG-, lgA-, lgE- –∞–љ—В–Є—В–µ–ї–∞.?
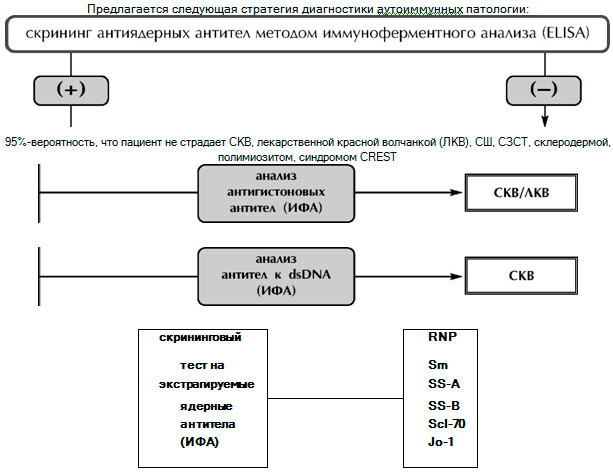
–Р—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞ —П–≤–ї—П—О—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є –Љ–∞—А–Ї–µ—А–∞–Љ–Є, –љ–Њ –Є –њ–Њ–Љ–Њ–≥–∞—О—В –Њ–њ—А–µ–і–µ–ї–Є—В—М —Б—В–µ–њ–µ–љ—М –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–µ–Ј–љ–Є –Є –µ–µ –њ—А–Њ–≥–љ–Њ–Ј. –Я—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Ї–∞–Ї –≤ —Б—В–Њ—А–Њ–љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—П —В–Є—В—А–Њ–≤, —В–∞–Ї –Є –Є—Е —Б–љ–Є–ґ–µ–љ–Є—П. –Э–∞–њ—А–Є–Љ–µ—А, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В, —З—В–Њ —Б–ї—Г—З–∞–Є –°–Ъ–Т, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –∞–љ—В–Є—В–µ–ї–∞ –Ї dsDNA, –Є–Љ–µ—О—В –ї—Г—З—И–Є–є –њ—А–Њ–≥–љ–Њ–Ј, —З–µ–Љ –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е. –Ю—В—Б—Г—В—Б—В–≤–Є–µ —Н—В–Є—Е –∞–љ—В–Є—В–µ–ї –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М—Б—П —В–µ–Љ, —З—В–Њ –Њ–љ–Є –Њ—В–Ї–ї–∞–і—Л–≤–∞—О—В—Б—П –≤ –њ–Њ—З–Ї–∞—Е, –њ—А–Є–≤–Њ–і—П –Ї —А–∞–Ј–≤–Є—В–Є—О –ї—О–њ—Г—Б-–љ–µ—Д—А–Є—В–∞.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є
–Э–µ–Ї–Њ—В–Њ—А—Л–Љ —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–Љ –њ–∞—В–Њ–ї–Њ–≥–Є—П–Љ —Б–Њ–њ—Г—В—Б—В–≤—Г–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ї–Њ—В–Њ—А—Л—Е –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Є–Љ–µ–µ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ. –≠—В–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –Є–љ—Б—Г–ї–Є–љ-–Ј–∞–≤–Є—Б–Є–Љ—Л–є –і–Є–∞–±–µ—В, –њ–µ—А–љ–Є–Є–Є–Њ–Ј–љ–∞—П –∞–љ–µ–Љ–Є—П, –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–є –≥–∞—Б—В—А–Є—В –Є –і—А.
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –Є–Ј—Г—З–µ–љ–Њ –Њ–Ї–Њ–ї–Њ –і–µ—Б—П—В–Ї–∞ –Њ—А–≥–∞–љ–Њ—Б–њ–µ–Є–Є—Д–Є—З–µ—Б–Ї–Є—Е–∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Ї —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л–Љ –∞–љ—В–Є–≥–µ–љ–∞–Љ —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –њ–Њ—П–≤–ї—П—О—Й–Є—Е—Б—П –≤ —Б–Є—Б—В–µ–Љ–љ–Њ–є –Є–Є—А–Ї—Г–ї—П–Є–Є–Є –њ—А–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–Њ–Љ—В–Є—А–µ–Њ–Є- –і–Є—В–µ –Є –і–Є—Д—Д—Г–Ј–љ–Њ–Љ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–Љ –Ј–Њ–±–µ. –Э–∞–Є–±–Њ–ї–µ–µ —Е–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ—Л–Љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (–∞–љ—В–Є–≥–µ–љ–∞–Љ–Є), –Ї –Ї–Њ—В–Њ—А—Л–Љ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –њ–Њ–і–Њ–±–љ—Л–µ –Є–Љ–Љ—Г–љ–љ—Л–µ —А–µ–∞–Ї–Є–Є–Є –Є –≤—Л—А–∞–±–∞—В—Л–≤–∞—О—В—Б—П –∞–љ—В–Є—В–µ–ї–∞, —П–≤–ї—П—О—В—Б—П —В–Є—А–µ–Њ–≥–ї–Њ–±—Г–ї–Є–љ (–Ґ–У) –Є —Д–µ—А–Љ–µ–љ—В —В–Є—А–µ–Њ–Є–і–љ–∞—П–њ–µ—А–Њ–Ї—Б–Є–і–∞–Ј–∞ (–Ґ–Я–Ю).–Т —Б–≤—П–Ј–Є —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –∞–±—Б–Њ–ї—О—В–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є —А–Њ–ї–Є —А–∞–Ј–і–µ–ї—М–љ–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –∞–љ—В–Є—В–µ–ї —Н—В–Є –Љ–∞—А–Ї–µ—А—Л –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –≤—Б–µ–≥–і–∞ —Б–ї–µ–і—Г–µ—В –Є—Б—Б–ї–µ–і–Њ–≤–∞—В—М –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ –∞–љ—В–Є-–Ґ–У + –∞–љ—В–Є-–Ґ–Я–Ю.
–Ґ–Я–Ю —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ –∞–љ—В–Є–≥–µ–љ–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ —В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ–Љ–Є–Ї—А–Њ—Б–Њ–Љ–∞–ї—М–љ–Њ–≥–Њ –∞–љ—В–Є–≥–µ–љ–∞ –Є –њ—А–µ–і-—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Б–ї–∞–±–Њ –≥–ї–Є–Ї–Њ–Ј–Є–ї–Є—А–Њ–≤–∞–љ–љ—Л–є–≥–µ–Љ-—Б–Њ–і–µ—А–ґ–∞—Й–Є–є –±–µ–ї–Њ–Ї, –Є–≥—А–∞—О—Й–Є–є –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ—А–Њ–Є–µ—Б- —Б–µ –є–Њ–і–Є—А–Њ–≤–∞–љ–Є—П —В–Є—А–µ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ –Є —Б–Є–љ—В–µ–Ј–µ —В–Є—А–µ–Њ–Є–і–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤. –Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ –∞–љ—В–Є—В–µ–ї –Ї –Ґ–Я–Ю –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ –∞–љ—В–Є—В–µ–ї –Ї –Љ–Є–Ї—А–Њ—Б–Њ–Љ–∞–ї—М–љ–Њ–є—Д—А–∞–Ї–Є–Є–Є –Є–Љ–µ–µ—В —А—П–і –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –Є–Ј-–Ј–∞ –њ—А–Є—Б—Г—В—Б—В–≤–Є—П –≤ –Љ–Є–Ї—А–Њ—Б–Њ–Љ–∞–ї—М–љ–Њ–є—Д—А–∞–Ї–Є–Є–Є –Є–љ—В–µ—А—Д–µ—А–Є—А—Г—О—Й–Є—Е —В–Є—А–µ–Њ–Є–і–љ—Л—Е –∞–љ—В–Є–≥–µ–љ–Њ–≤ –Є –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї, –∞ —В–∞–Ї–ґ–µ –љ–µ–±–Њ–ї—М—И–Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤ —В–Є—А–µ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞. –Р–љ—В–Є—В–µ–ї–∞ –Ї –Ґ–Я–Ю –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –њ–∞–Є–Є–µ–љ—В–Њ–≤ —Б –Ј–Њ–±–љ—Л–Љ –Є –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ —В–Є—А–µ–Њ–Є–і–Є—В–Њ–Љ –Є–ї–Є –њ–µ—А–≤–Є—З–љ—Л–Љ —В–Є—А–µ–Њ—В–Њ–Ї—Б–Є–Ї–Њ–Ј–Њ–Љ. –Э–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –Ї–Њ–љ–Є–µ–љ-—В—А–∞–Є–Є–Є –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В —Г –њ–∞–Є–Є–µ–љ—В–Њ–≤ —Б —Д–Є–±—А–Њ–Ј–љ—Л–Љ –Є –Њ–Ї—Б–Є—Д–Є–ї—М–љ—Л–Љ –≤–∞—А–Є–∞–љ—В–∞–Љ–Є –Ј–Њ–±–∞ –•–∞—И–Є–Љ–Њ—В–Њ. –£ –њ–∞–Є–Є–µ–љ—В–Њ–≤ —Б –±–Њ–ї–µ–Ј–љ—М—О –У—А–µ–є–≤—Б–∞ –Њ–±—А–∞–Ј—Г—О—В—Б—П –Њ–±–∞ —В–Є–њ–∞ –∞–љ—В–Є—В–µ–ї, –љ–Њ –≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –љ–Є–Ј–Ї–Є—Е –Ї–Њ–љ–Є–µ–љ—В—А–∞–Є–Є—П—Е. –Т—Л—Б–Њ–Ї–Є–µ –Ї–Њ–љ–Є–µ–љ—В—А–∞–Є–Є–Є –∞–љ—В–Є—В–µ–ї –Ї –Ґ–У —Е–∞—А–∞–Ї—В–µ—А–љ—Л –і–ї—П —Б—Л–≤–Њ—А–Њ—В–Њ–Ї –њ–∞–Є–Є–µ–љ—В–Њ–≤ —Б –≥–Є–њ–Њ—Д—Г–љ–Ї–Є–Є–µ–є —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, —Д–Є–±—А–Њ–Ј–љ—Л–Љ –Ј–Њ–±–Њ–Љ –•–∞—И–Є–Љ–Њ—В–Њ, –Љ–Є–Ї—Б–µ–і–µ–Љ–Њ–є.–Р–љ—В–Є—В–Є—А–µ–Њ–Є–і–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞ –±–Њ–ї–µ–µ —Е–∞—А–∞–Ї—В–µ—А–љ—Л –і–ї—П –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –≤ —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е —В–Є—В—А—Л –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –≤—Л—И–µ.
–Ь–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –∞–љ—В–Є—В–µ–ї –њ—А–Њ—В–Є–≤ –Њ—Б—В—А–Њ–≤–Ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –Є –Є–љ—Б—Г–ї–Є–љ–∞, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —П–≤–ї—П–µ—В—Б—П –њ—А–Є—З–Є–љ–Њ–є —А–∞–Ј–≤–Є—В–Є—П –±–Њ–ї–µ–Ј–љ–Є –Є –і–µ—Б—В—А—Г–Ї–Є–Є–Є –†-–Ї–ї–µ—В–Њ–Ї. –Р–љ—В–Є—В–µ–ї–∞ –Ї –Є–љ—Б—Г–ї–Є–љ—Г –љ–∞—Е–Њ–і—П—В —Г 35-40% –њ–∞–Є–Є–µ–љ—В–Њ–≤ —Б –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ I —В–Є–њ–∞. –°–Њ–Њ–±—Й–∞–ї–Њ—Б—М –Њ –Ї–Њ—А—А–µ–ї—П–Є–Є–Є –Љ–µ–ґ–і—Г –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –∞–љ—В–Є—В–µ–ї –Ї –Є–љ—Б—Г–ї–Є–љ—Г –Є –∞–љ—В–Є—В–µ–ї –Ї –Њ—Б—В—А–Њ–≤–Ї–Њ–≤—Л–Љ –Ї–ї–µ—В–Ї–∞–Љ. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В –±—Л–ї –љ–∞–є–і–µ–љ –Њ—Б–љ–Њ–≤–љ–Њ–є –∞–љ—В–Є–≥–µ–љ, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–є —Б–Њ–±–Њ–є –≥–ї–∞–≤–љ—Г—О –Љ–Є—И–µ–љ—М –і–ї—П –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Є–љ—Б—Г–ї–Є–љ–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞. –≠—В–Є–Љ –∞–љ—В–Є–≥–µ–љ–Њ–Љ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –і–µ–Ї–∞—А–±–Њ–Ї—Б–Є–ї–∞–Ј–∞–≥–ї—Г-—В–∞–Љ–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л(GAD),–Љ–µ–Љ–±—А–∞–љ–љ—Л–є —Д–µ—А–Љ–µ–љ—В, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—Й–Є–є –±–Є–Њ—Б–Є–љ—В–µ–Ј —В–Њ—А–Љ–Њ–Ј–љ–Њ–≥–Њ –љ–µ–є—А–Њ- –Љ–µ–і–Є–∞—В–Њ—А–∞ –Є–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Љ–ї–µ–Ї–Њ–њ–Є—В–∞—О—Й–Є—Е - –≥–∞–Љ–Љ–∞-–∞–Љ–Є–љ–Њ–Љ–∞—Б–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–У–Р–Ь–Ъ). –Р–љ—В–Є-GAD- —Н—В–Њ –Њ—З–µ–љ—М –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ—Л–є –Љ–∞—А–Ї–µ—А –і–ї—П –Є–і–µ–љ—В–Є—Д–Є–Ї–∞–Є–Є–Є–њ—А–µ–і–і–Є–∞–±–µ—В–∞, –∞ —В–∞–Ї–ґ–µ –≤—Л—П–≤–ї–µ–љ–Є—П –Є–љ–і–Є–≤–Є–і—Г—Г–Љ–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞. –Т–Њ –≤—А–µ–Љ—П –∞—Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ-—Б–Ї–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –і–Є–∞–±–µ—В–∞ –∞–љ—В–Є—В–µ–ї–∞ –Ї GAD–Љ–Њ–≥—Г—В –і–µ—В–µ–Ї—В–Є—А–Њ–≤–∞—В—М—Б—П —Г –њ–∞–Є–Є–µ–љ—В–∞ –Ј–∞ 7-14 –ї–µ—В –і–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –±–Њ–ї–µ–Ј–љ–Є (—Б–Љ. —А–∞–Ј–і–µ–ї ¬Ђ–°–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В¬ї).
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ —Б–Є—Б—В–µ–Љ–љ—Л—Е –≤–∞—Б–Ї—Г–ї–Є—В–Њ–≤ –Є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –њ–Њ—З–µ–Ї –Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞
–Т–∞—Б–Ї—Г–ї–Є—В—Л - —Н—В–Њ –≥—А—Г–њ–њ–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤ –Њ—Б–љ–Њ–≤–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ї–Њ—В–Њ—А—Л—Е –ї–µ–ґ–Є—В –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є. –≠—В–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ–Њ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ–µ, –Њ–±—Й–Є–Љ –і–ї—П –љ–Є—Е —П–≤–ї—П–µ—В—Б—П –Є–љ-—Д–Є–ї—М—В—А–∞–Є–Є—П —Б—В–µ–љ–Ї–Є —Б–Њ—Б—Г–і–Њ–≤ –Ї–ї–µ—В–Ї–∞–Љ–Є –≥–µ–Љ–∞—В–Њ–≥–µ–љ–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П –≤ –≤–Є–і–µ —Б–Ї–Њ–њ–ї–µ–љ–Є–є –Є–ї–Є –≥—А–∞–љ—Г–ї–µ–Љ (–љ–µ–є—В—А–Њ—Д–Є–ї—Л, –Љ–Њ–љ–Њ–Є–Є—В—Л, –ї–Є–Љ—Д–Њ–Є–Є—В—Л, –њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –Ї–ї–µ—В–Ї–Є, –Љ–∞–Ї—А–Њ—Д–∞–≥–Є –Є –і—А.). –Ґ–Ї–∞–љ–µ–≤—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ—А–Њ—П–≤–ї—П—О—В—Б—П –љ–∞–±—Г—Е–∞–љ–Є–µ–Љ, –њ—А–Њ–ї–Є—Д–µ—А–∞–Є–Є–µ–є —Н–љ–і–Њ—В–µ–ї–Є—П, —В—А–Њ–Љ–±–Њ–Ј–∞–Љ–Є, –≥–µ–Љ–Њ—А—А–∞–≥–Є—П–Љ–Є, –љ–µ–Ї—А–Њ–Ј–∞–Љ–Є. –Я–Њ—Н—В–Њ–Љ—Г –і–Њ–≤–Њ–ї—М–љ–Њ —З–∞—Б—В–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Н—В–Њ–є –≥—А—Г–њ–њ—Л –љ–∞–Ј—Л–≤–∞—О—В –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А—Г—О—Й–Є–Љ–Є–≤–∞—Б–Ї—Г–ї–Є—В–∞- –Љ–Є. –Т —Б—В–µ–љ–Ї–µ —Б–Њ—Б—Г–і–Њ–≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ–≥–і–∞ –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ—Л, –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В, –Є–Љ–Љ—Г–љ–љ—Л–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б—Л –Є –Є–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ–ї–Є–Љ—Д–Њ–Є–Є—В—Л. –°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Б–Є—Б—В–µ–Љ–љ—Л—Е –≤–∞—Б–Ї—Г–ї–Є—В–Њ–≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —В—А—Г–і–љ–Њ –Є–і–µ–љ—В–Є—Д–Є–Є–Є—А–Њ–≤–∞—В—М –Є –≤–µ—А–Є—Д–Є–Є–Є—А–Њ–≤–∞—В—М –≤ –≤–Є–і–µ —З–µ—В–Ї–Њ –Њ—З–µ—А—З–µ–љ–љ—Л—Е —Б–Є–љ–і—А–Њ–Љ–Њ–≤, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –љ–µ—А–µ–і–Ї–Њ –≤—Б—В—А–µ—З–∞—О—В—Б—П –њ–µ—А–µ—Е–Њ–і–љ—Л–µ —Д–Њ—А–Љ—Л –Є–ї–Є –Њ–љ–Є —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –≤ —А–∞–Љ–Ї–∞—Е –і—А—Г–≥–Є—Е —Б–Є–љ–і—А–Њ–Љ–Њ–≤ (–≤–∞—Б–Ї—Г–ї–Є—В—Л –њ—А–Є –Њ–њ—Г—Е–Њ–ї—П—Е, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Є –њ–µ—З–µ–љ–Є, –≤–∞—Б–Ї—Г–ї–Є—В—Л –њ–Њ—Б–ї–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞–Є–Є–Є, —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–∞—П –±–Њ–ї–µ–Ј–љ—М, –≤–∞—Б–Ї—Г–ї–Њ–њ–∞—В–Є—П –њ—А–Є –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ –Є –і—А).
–Ь–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ –Є–Љ–Љ—Г–љ–Њ–Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–Њ—З–µ–Ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —В–∞–Ї–Њ–≤–Њ–є –њ—А–Є –Њ—Б—В—А–Њ–Љ –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –≥–ї–Њ–Љ–µ—А—Г–ї–Њ–љ–µ—Д—А–Є—В–µ. –Т —Н—В—Г –≥—А—Г–њ–њ—Г –Њ–±—К–µ–і–Є–љ–µ–љ—Л –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ–Є–µ—Б—Б—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —В–Є–њ–∞–Љ–Є –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ–Њ—З–µ—З–љ–Њ–є —В–Ї–∞–љ–Є. –Ф–∞–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Љ–Њ–≥—Г—В –±—Л—В—М –Є–ї–Є –Њ—В–і–µ–ї—М–љ—Л–Љ–Є –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –µ–і–Є–љ–Є—Ж–∞–Љ–Є –Є–ї–Є —З–∞—Б—В—М—О –Є–Љ–Љ—Г–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –љ–∞–њ—А–Є–Љ–µ—А, –≤–∞—Б–Ї—Г–ї–Є-—В–Њ–≤, –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є. –Т –њ–Њ—Б–ї–µ–і–љ–µ–Љ —Б–ї—Г—З–∞–µ –њ–∞—В–Њ–ї–Њ–≥–Є—П –њ–Њ—З–µ–Ї –Њ–њ—А–µ–і–µ–ї—П–µ—В —В—П–ґ–µ—Б—В—М –Є –Є—Б—Е–Њ–і –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Ю—В–Ї—А—Л—В–Є–µ –∞–љ—В–Є—В–µ–ї –Ї –љ–µ–є—В—А–Њ—Д–Є–ї—М–љ—Л–Љ —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ –∞–љ—В–Є–≥–µ–љ–∞–Љ (ANCA),–≤—Л—Б–Њ–Ї–Њ —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л—Е (–±–Њ–ї–µ–µ 90%) –і–ї—П —Б–Є—Б—В–µ–Љ–љ—Л—Е –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А—Г—О—Й–Є—Е–≤–∞—Б–Ї—Г–ї–Є—В–Њ–≤ –Є –≤, –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М, –і–ї—П –≥—А–∞–љ—Г–ї–µ–Љ–∞—В–Њ–Ј–∞–Т–µ–≥–µ–љ–µ—А–∞ (–У–Т) –Є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–Є–∞—А—В–µ—А–Є–Є—В–∞ (–Ь–Я–Р), –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–Є–ї–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г —Н—В–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є. ANCA–Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –Ї–∞–Ї –Ї–Њ–Љ–њ–ї–µ–Ї—Б –∞–љ—В–Є—В–µ–ї, —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л—Е –Ї —А–∞–Ј–ї–Є—З–љ—Л–Љ –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–∞—А- –љ—Л–Љ, –Љ–Њ–љ–Њ—Ж–Є—В–∞—А–љ—Л–Љ –Є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л–Љ —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ –∞–љ—В–Є–≥–µ–љ–∞–Љ. –°—Г—Й–µ—Б—В–≤—Г—О—В 2 –њ–Њ–і–Ї–ї–∞—Б—Б–∞ –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Ї –љ–µ–Ш—В—А–Њ—Д–Є–ї–∞–Љ —З–µ–ї–Њ–≤–µ–Ї–∞: —Б-ANCA(—Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ ANCA) –Є —А-ANCA(–њ–µ—А–Є–љ—Г–Ї–ї–µ–∞—А–љ—Л–µANCA). –Э–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–Љ–Є —П–≤–ї—П—О—В—Б—П –∞–љ—В–Є—В–µ–ї–∞ –Ї —Д–µ—А–Љ–µ–љ—В–∞–Љ –њ–µ—А–≤–Є—З–љ—Л—Е –≥—А–∞–љ—Г–ї: –њ—А–Њ—В–µ–Є–љ–∞–Ј–µ-3 (PR3)–Є –Љ–Є–µ–ї–Њ–њ–µ—А–Њ–Ї—Б–Є–і–∞–Ј–µ (–Ь–†–Ю), —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П PR3 –Є MPO–Њ–њ—А–µ–і–µ–ї–µ–љ—Л –Ї–∞–Ї —Б–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Љ–∞—А–Ї–µ—А—Л –њ–µ—А–≤–Є—З–љ—Л—Е —Б–Є—Б—В–µ–Љ–љ—Л—Е –≤–∞—Б–Ї—Г–ї–Є—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ—Л –Њ–±—Л—З–љ–Њ —И–Є—А–µ, —З–µ–Љ –њ–Њ–ї–∞–≥–∞—О—В: –Њ—В 1,5 –і–Њ 5 –љ–∞ 1000 –≤ —Б—В–∞—А—И–µ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ–µ.
–Ъ —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ —Б-ANCA–Њ—В–љ–Њ—Б—П—В—Б—П PR3 –Є BPI(—Г—Б–Є–ї–Є–≤–∞—О—Й–Є–є –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –±–µ–ї–Њ–Ї). –Т 90% —Б–ї—Г—З–∞–µ–≤ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, —Б–Њ–і–µ—А–ґ–∞—Й–µ–є —Б-ANCA, —Ж–µ–ї–µ–≤—Л–Љ –∞–љ—В–Є–≥–µ–љ–Њ–Љ —П–≤–ї—П–µ—В—Б—П PR3. PR3 –±—Л–ї–∞ –њ–µ—А–≤–Њ–є –Њ–њ–Є—Б–∞–љ–∞ –Ї–∞–Ї –Њ—Б–љ–Њ–≤–љ–Њ–є –∞–љ—В–Є–≥–µ–љ –њ—А–Є –≥—А–∞–љ—Г–ї–Њ–Љ–∞—В–Њ–Ј–µ–Т–µ–≥–µ–љ–µ—А–∞. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–Є–∞—А—В–µ—А–Є–Є—В–∞, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ —Б –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є —З–∞—Б—В–Њ—В–Њ–є –≤—Б—В—А–µ—З–∞—О—В—Б—П –Ї–∞–Ї –∞–љ—В–Є-PR3, —В–∞–Ї –Є –∞–љ—В–Є- –Ь–†–Ю, –і–ї—П –У–Т —Б–≤–Њ–є—Б—В–≤–µ–љ–љ—Л –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞, —А–µ–∞–≥–Є—А—Г—О—Й–Є–µ —Б PR3 (–±–Њ–ї–µ–µ 90%). –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ ANCA—Б –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є —Н–њ–Є—В–Њ–њ–љ–Њ–Ш —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О –і–ї—П –і–Є—Д-—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –У–Т –Є –Ь–Я–Р, –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–∞—А–Ї–µ—А–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤–∞—Б–Ї—Г–ї–Є—В–∞ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е. –Я—А–Є —Н—В–Њ–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞–љ—В–Є—В–µ–ї –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –њ–Њ –≤—А–µ–Љ–µ–љ–Є –њ—А–µ–і—И–µ—Б—В–≤–Њ–≤–∞–ї–Њ –њ–Њ—П–≤–ї–µ–љ–Є—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Њ–±–Њ—Б—В—А–µ–љ–Є—П. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ ANCA–Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤–∞—Б–Ї—Г–ї–Є—В–∞ –Є–Љ–µ–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –њ–µ—А–µ–і —В–∞–Ї–Є–Љ–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є, –Ї–∞–Ї –°–Ю–≠ –Є –°-—А–µ–∞–Ї—В–Є–≤–љ—Л–Ш –±–µ–ї–Њ–Ї (—Б-–†–С), –±–Њ–ї–µ–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ –Њ—В—А–∞–ґ–∞—П —Б—В–µ–њ–µ–љ—М –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –°–Ю–≠ –Є –°-–†–С, –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –њ–Њ–≤—Л—И–µ–љ–Є—П —В–Є—В—А–∞ ANCA–Њ—В –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є—П –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ AN–°A –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –±–Њ–ї–µ–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ —В–µ—Б—В–Њ–Љ –≤ –Њ—Ж–µ–љ–Ї–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П —Г –±–Њ–ї—М–љ—Л—Е –∞–Ї—В–Є–≤–љ—Л–Љ –У–Т —Б –Љ–µ–љ—М—И–µ–є —З–∞—Б—В–Њ—В–Њ–є (50%).
MPO —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ –∞–љ—В–Є–≥–µ–љ–Њ–Љ-–Љ–Є—И–µ–љ—М—О –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –≤ 40% —А-ANCA–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —Б—Л–≤–Њ-—А–Њ—В–Њ–Ї –Є –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–Љ –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А—Г—О—Й–Є–Љ –Є —Б–µ—А–њ–Њ–≤–Є–і–љ—Л–Љ –≥–ї–Њ–Љ–µ—А—Г–ї–Њ–љ–µ—Д—А–Є—В–Њ–Љ, —Г–Ј–µ–ї–Ї–Њ–≤—Л–Љ –њ–µ—А–Є–∞—А—В–µ—А–Є–Є—В–Њ–Љ –Є –≤–∞—Б–Ї—Г–ї–Є—В–Њ–Љ. –Р–љ—В–Є-–Ь–†–Ю –≤—Л—Б–Њ–Ї–Њ-—Б–њ–µ—Ж–Є—Д–Є—З–љ—Л –і–ї—П —Н—В–Њ–Ш –≥—А—Г–њ–њ—Л –љ–∞—А—Г—И–µ–љ–Є–Є, —Е–Њ—В—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –љ–µ –Є—Б–Ї–ї—О—З–∞–µ—В –љ–∞–ї–Є—З–Є—П –Ј–∞–±–Њ-–ї–µ–≤–∞–љ–Є—П. –Р–љ—В–Є-–Ь–†–Ю –Љ–Њ–≥—Г—В —В–∞–Ї–ґ–µ –њ—А–Є—Б—Г—В—Б—В–≤–Њ–≤–∞—В—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–Є–і—А–∞–Ј–Є–љ-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ –≥–ї–Њ–Љ–µ—А—Г-–ї–Њ–љ–µ—Д—А–Є—В–Њ–Љ –Є —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –У—Г–і–њ–∞—Б—З–µ—А–∞. –Ю–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Ш —В–Є—В—А —А-ANCA–љ–µ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б —В—П–ґ–µ—Б—В—М—О —Б–Њ-—Б—Г–і–Є—Б—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –љ–Њ –Є–Љ–µ–µ—В –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П –њ—А–µ–і—Б–Ї–∞–Ј–∞–љ–Є—П —А–∞–Ј–≤–Є—В–Є—П –±–Њ–ї–µ–Ј–љ–Є.
–Э–Њ–≤—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤—Л—П–≤–ї–µ–љ –Є –Њ—Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–љ —А—П–і –љ–Њ–≤—Л—Е –њ–µ—А–Є–љ—Г–Ї–ї–µ–∞—А–љ—Л—Е —А-ANCA: —Н–ї–∞—Б—В–∞–Ј–∞, –Ї–∞—В–µ–њ—Б–Є–љD, –ї–Є–Ј–Њ—Ж–Є–Љ, –ї–∞–Ї—В–Њ—Д–µ—А—А–Є–љ –Є –Т–†1. –Я—А–Є—Б—Г—В—Б—В–≤–Є–µ –∞—В–Є–њ–Є—З–љ—Л—Е —А-ANCA–Љ–Њ–ґ–µ—В –Ј–∞—В—А—Г–і–љ—П—В—М –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є—О —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б-ANCA–Є —А-ANCA–≤ —Б–ї—Г—З–∞–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Љ–µ—В–Њ–і–∞ –љ–µ–њ—А—П–Љ–Њ–Ш–Є–Љ–Љ—Г–љ–Њ—Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—Ж–Є–Є, —В–∞–Ї –Ї–∞–Ї –∞—В–Є–њ–Є—З–љ—Л–µ —А-ANCA–љ–µ –≤—Б–µ–≥–і–∞ —Б–≤—П–Ј–∞–љ—Л —Б –≤–∞—Б–Ї—Г–ї–Є—В–∞–Љ–Є. –Р—В–Є–њ–Є—З–љ—Л–µ —А-ANCA–њ–Њ—П–≤–ї—П—О—В—Б—П –њ—А–Є —Ж–µ–ї–Њ–Љ —А—П–і–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —П–Ј–≤–µ–љ–љ–Њ–Љ –Ї–Њ–ї–Є—В–µ, —Б–Ї–ї–µ—А–Њ–Ј–Є—А—Г—О—Й–µ–Љ —Е–Њ–ї–∞–љ–≥–Є—В–µ –Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є. BPl- —Н—В–Њ –Љ–µ–Љ–±—А–∞–љ–љ—Л–є –±–µ–ї–Њ–Ї –њ–Њ–ї–Є–Љ–Њ—А—Д–љ–Њ—П–і–µ—А–љ—Л—Е –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤ –Є –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–є —Б–≤—П–Ј—Л–≤–∞–µ—В —Н–љ–і–Њ—В–Њ–Ї—Б–Є–љ—Л.
–Р–љ—В–Є-GBM(–∞–љ—В–Є—В–µ–ї–∞ –Ї –±–∞–Ј–∞–ї—М–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ–µ –Ї–ї—Г–±–Њ—З–Ї–Њ–≤) –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤—Л–Ј—Л–≤–∞—О—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–є –≥–ї–Њ–Љ–µ—А—Г–ї–Њ–љ–µ—Д—А–Є—В–±–µ–Ј –Є–ї–Є —Б –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–µ–Љ –≤ –ї–µ–≥–Ї–Є–µ (—Б–Є–љ–і—А–Њ–Љ –У—Г–і–њ–∞—Б—З–µ—А–∞). –Р–љ—В–Є—В–µ–ї–∞ –Є–Љ–µ—О—В –≤—Л—Б–Њ–Ї—Г—О (>90%) —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –і–ї—П —Б–Є–љ–і—А–Њ–Љ–∞ –У—Г–і–њ–∞—Б—З–µ—А–∞. –Ґ–Є—В—А—Л –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Ї–Њ—А—А–µ–ї–Є—А—Г—О—В —Б –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –њ—А–Њ—Ж–µ—Б—Б–∞, –њ–Њ—Н—В–Њ–Љ—Г –Є—Е –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –і–ї—П –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞ –±–Њ–ї–µ–Ј–љ–Є.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞
–Ш–Ј—Г—З–µ–љ–Є–µ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л—Е –∞–љ—В–Є—В–µ–ї (–Р–§–Ы) —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–∞—З–∞–ї–Њ—Б—М –µ—Й–µ –≤ –љ–∞—З–∞–ї–µ –≤–µ–Ї–∞ —Б —А–∞–Ј—А–∞–±–Њ—В–Ї–Є –Т–∞—Б—Б–µ—А–Љ–∞–љ–Њ–Љ —Б–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Б–Є—Д–Є–ї–Є—Б–∞ (—А–µ–∞–Ї—Ж–Є—П –Т–∞—Б—Б–µ—А–Љ–∞–љ–∞). –Т –љ–∞—З–∞–ї–µ 40-—Е –≥–Њ–і–Њ–≤ –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –Њ—Б–љ–Њ–≤–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ, —Б –Ї–Њ—В–Њ—А—Л–Љ —А–µ–∞–≥–Є—А—Г—О—В –∞–љ—В–Є—В–µ–ї–∞ –≤ —А–µ–∞–Ї—Ж–Є–Є –Т–∞—Б—Б–µ—А–Љ–∞–љ–∞, —П–≤–ї—П–µ—В—Б—П –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ –Ј–∞—А—П–ґ–µ–љ–љ—Л–є —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і –Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ. –Т –љ–∞—З–∞–ї–µ 50-—Е –≥–Њ–і–Њ–≤ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–∞—Е –±–Њ–ї—М–љ—Л—Е —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Њ–є –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –Є–љ–≥–Є–±–Є—В–Њ—А —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є, –Ї–Њ—В–Њ—А—Л–є –±—Л–ї –љ–∞–Ј–≤–∞–љ –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–Љ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–Љ (–Т–Р). –£ —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е –љ–∞–Љ–љ–Њ–≥–Њ —З–∞—Й–µ –≤—Б—В—А–µ—З–∞—О—В—Б—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П.
–Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –∞–љ—В–Є–Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ–Њ–≤—Л–µ –∞–љ—В–Є—В–µ–ї–∞ —П–≤–ї—П—О—В—Б—П –Љ–∞—А–Ї–µ—А–Њ–Љ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ (–Р–§–°). –Я–Њ–і –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –њ–Њ–љ–Є–Љ–∞—О—В –≤–µ–љ–Њ–Ј–љ—Л–µ –Є/–Є–ї–Є –∞—А—В–µ—А–Є–∞–ї—М–љ—Л–µ —В—А–Њ–Љ–±–Њ–Ј—Л, —А–∞–Ј–ї–Є—З–љ—Л–µ —Д–Њ—А–Љ—Л –∞–Ї—Г—И–µ—А—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є (–њ—А–Є–≤—Л—З–љ–Њ–µ–љ–µ–≤—Л–љ–∞—И–Є–≤–∞–љ–Є–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є), —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—О, –∞ —В–∞–Ї–ґ–µ –і—А—Г–≥–Є–µ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л–µ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ, –Ї–Њ–ґ–љ—Л–µ, —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–µ, –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П. –Ґ–µ—З–µ–љ–Є–µ –Р–§–°, —В—П–ґ–µ—Б—В—М –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–µ–њ—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ—Л. –£ –Њ–і–љ–Є—Е –±–Њ–ї—М–љ—Л—Е –Р–§–° –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–µ–љ–Њ–Ј–љ—Л–Љ–Є —В—А–Њ–Љ–±–Њ–Ј–∞–Љ–Є, —Г –і—А—Г–≥–Є—Е - –Є–љ—Б—Г–ї—М—В–Њ–Љ, —Г —В—А–µ—В—М–Є—Е - –∞–Ї—Г—И–µ—А—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –Є–ї–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є. –Р–§–° –љ–∞–Ј—Л–≤–∞—О—В –њ–µ—А–≤–Є—З–љ—Л–Љ, –µ—Б–ї–Є –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є –µ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –њ—А–Є–Ј–љ–∞–Ї–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є; –Є –≤—В–Њ—А–Є—З–љ—Л–Љ - –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є –µ–≥–Њ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т. –Я–µ—А–≤–Є—З–љ—Л–є –Є –≤—В–Њ—А–Є—З–љ—Л–є –Р–§–° –Є–Љ–µ—О—В —Б—Е–Њ–і–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П; –њ–µ—А–≤–Є—З–љ—Л–є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –±–Њ–ї–µ–µ, —З–µ–Љ –≤ –њ–Њ–ї–Њ–≤–Є–љ–µ —Б–ї—Г—З–∞–µ–≤, –≤—В–Њ—А–Є—З–љ—Л–є —З–∞—Й–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –љ–∞ —Д–Њ–љ–µ –љ–µ–≤—Л—Б–Њ–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ –Р–§–Ы-–љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ –Р–§–°, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Є–Љ–µ—О—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –љ–Њ –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–µ —Б–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Љ–∞—А–Ї–µ—А—Л - –Т–Р –Є –∞–љ—В–Є—В–µ–ї–∞ –Ї –Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ—Г. –Т —Б—Л–≤–Њ—А–Њ—В–Ї–∞—Е –љ–µ–Ї–Њ—В–Њ—А—Л—Е —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П —В–Њ–ї—М–Ї–Њ –∞–љ—В–Є—В–µ–ї–∞ –Ї ^2-–≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ—Г l(^2-–У–Я l) –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–Є –∞–љ—В–Є—В–µ–ї –Ї –Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ—Г. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Є –Р–§–° –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Љ–Њ–≥—Г—В –њ–Њ—А–∞–ґ–∞—В—М—Б—П —Б–Њ—Б—Г–і—Л –ї—О–±–Њ–≥–Њ –Ї–∞–ї–Є–±—А–∞ –Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є: –Њ—В –Ї–∞–њ–Є–ї–ї—П—А–Њ–≤ –і–Њ –Ї—А—Г–њ–љ—Л—Е, –≤–Ї–ї—О—З–∞—П –∞–Њ—А—В—Г, —Б–њ–µ–Ї—В—А –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–µ–љ. –Т —А–∞–Љ–Ї–∞—Е –Р–§–° –Њ–њ–Є—Б–∞–љ—Л –њ–∞—В–Њ–ї–Њ–≥–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л, –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї, –њ–µ—З–µ–љ–Є, —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –ґ–µ–ї–µ–Ј, –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞.
–Э–∞–Є–±–Њ–ї–µ–µ —Е–∞—А–∞–Ї—В–µ—А–љ—Л–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Р–§–° —П–≤–ї—П–µ—В—Б—П –∞–Ї—Г—И–µ—А—Б–Ї–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П. –Р–Ї—Г—И–µ—А—Б–Ї–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –љ–∞–ї–Є—З–Є–µ–Љ –Р–§–Ы, –≤–Ї–ї—О—З–∞—О—В: –њ—А–Є–≤—Л—З–љ–Њ–µ–љ–µ–≤—Л–љ–∞—И–Є–≤–∞–љ–Є–µ (–і–≤–∞ –Є –±–Њ–ї–µ–µ —Б–∞–Љ–Њ–њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ—Л—Е –≤—Л–Ї–Є–і—Л—И–∞ –Є–ї–Є –љ–µ—А–∞–Ј–≤–Є–≤–∞—О—Й–Є–µ—Б—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –≤ l–Є ll—В—А–Є–Љ–µ—Б—В—А–∞—Е), –∞–љ—В–µ–љ–∞—В–∞–ї—М–љ—Г—О –≥–Є–±–µ–ї—М –њ–ї–Њ–і–∞, –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ—Л–µ —А–Њ–і—Л, —В—П–ґ–µ–ї—Л–µ —Д–Њ—А–Љ—Л –≥–µ—Б—В–Њ–Ј–∞, –Ј–∞–і–µ—А–ґ–Ї—Г –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –њ–ї–Њ–і–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є –Є –±–µ–Ј —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≥–µ—Б—В–Њ–Ј–∞, —В—П–ґ–µ–ї—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞. –Я–Њ—В–µ—А—П –њ–ї–Њ–і–∞ –њ—А–Є –°–Ъ–Т —Б–Њ—Б—В–∞–≤–ї—П–µ—В 91 % —Г –±–Њ–ї—М–љ—Л—Е —Б –Р–§–Ы –Є —В–Њ–ї—М–Ї–Њ 6% —Г –±–Њ–ї—М–љ—Л—Е –±–µ–Ј –љ–Є—Е. –Ю–њ–Є—Б–∞–љ ¬Ђ–љ–µ–Њ–љ–∞—В–∞–ї—М–љ—Л–є¬ї –Р–§–° —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –Њ—В –Љ–∞—В–µ—А–µ–є —Б –Р–§–°, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —В—А–∞–љ—Б–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–є –њ–µ—А–µ–і–∞—З–Є –Р–§–Ы.
–Ш—Б—В–Є–љ–љ–∞—П —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Р–§–° –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –љ–µ–Є–Ј–≤–µ—Б—В–љ–∞. –Р–§–Ы –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–∞—Е —Г 2-4% (–≤ –≤—Л—Б–Њ–Ї–Њ–Љ —В–Є—В—А–µ –Љ–µ–љ–µ–µ 0,2%) –Ј–і–Њ—А–Њ–≤—Л—Е –ї—О–і–µ–є, —З–∞—Й–µ —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ, —З–µ–Љ –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –І–∞—Б—В–Њ—В–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—П –Р–§–Ы —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Г –±–Њ–ї—М–љ—Л—Е —Б –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є, –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ–Є –Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є (–Т–Ш–І, –≥–µ–њ–∞—В–Є—В –° –Є –і—А.), –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П–Љ–Є, –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Њ—А–∞–ї—М–љ—Л–µ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤—Л, –њ—Б–Є—Е–Њ—В—А–Њ–њ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –Є –і—А.). –Р–§–Ы –љ–∞–є–і–µ–љ—Л –њ—А–Є–Љ–µ—А–љ–Њ —Г 20% –±–Њ–ї—М–љ—Л—Е –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞ –Є–ї–Є –Є–љ—Б—Г–ї—М—В, —Г 5-15% –ґ–µ–љ—Й–Є–љ —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є —Б–њ–Њ–љ—В–∞–љ–љ—Л–Љ–Є –∞–±–Њ—А—В–∞–Љ–Є. –Ц–µ–љ—Й–Є–љ—Л —Б –≤—Л—Б–Њ–Ї–Є–Љ —В–Є—В—А–Њ–Љ lgG–Р–§–Ы –Є–Љ–µ—О—В 28% –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —Б–њ–Њ–љ—В–∞–љ–љ—Л—Е –≤—Л–Ї–Є–і—Л—И–µ–є. –Т —Ж–µ–ї–Њ–Љ –Р–§–Ы –≤—Л—П–≤–ї—П—О—В—Б—П –њ—А–Є–Љ–µ—А–љ–Њ —Г —В—А–µ—В–Є –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т. –Т —Б–ї—Г—З–∞–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—П –Р–§–Ы –њ—А–Є –°–Ъ–Т —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –і–Њ 60-70%, –∞ –њ—А–Є –Є—Е –Њ—В—Б—Г—В—Б—В–≤–Є–Є - —Б–љ–Є–ґ–∞–µ—В—Б—П –і–Њ 10-15%.
–Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Р–§–° –њ—А–Њ–≤–Њ–і–Є—В—Б—П —Б —И–Є—А–Њ–Ї–Є–Љ –Ї—А—Г–≥–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –њ—А–Њ—В–µ–Ї–∞—О—Й–Є—Е —Б —Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є. –Я—А–Є –Р–§–° –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Њ—З–µ–љ—М –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –Є–Љ–Є—В–Є—А–Њ–≤–∞—В—М –≤–∞—Б–Ї—Г–ї–Є—В—Л, –Є–љ—Д–µ–Ї–Є–Є–Њ–љ–љ—Л–є —Н–љ–і–Њ–Ї–∞—А–і–Є—В, –Њ–њ—Г—Е–Њ–ї–Є —Б–µ—А–і–Є–∞, —А–∞—Б—Б–µ—П–љ–љ—Л–є —Б–Ї–ї–µ—А–Њ–Ј, –≥–µ–њ–∞—В–Є—В, –љ–µ—Д—А–Є—В –Є –і—А.
–Р–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —Б–µ–Љ–µ–є—Б—В–≤–Њ –∞–љ—В–Є—В–µ–ї, –Ї–Њ—В–Њ—А—Л–µ —А–∞—Б–њ–Њ–Ј–љ–∞—О—В –∞–љ—В–Є–≥–µ–љ–љ—Л–µ –і–µ—В–µ—А–Љ–Є–љ–∞–љ—В—Л –∞–љ–Є–Њ–љ–љ—Л—Е –Є –љ–µ–є—В—А–∞–ї—М–љ—Л—Е —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤ –Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–µ —Н–њ–Є—В–Њ–њ—Л, –Њ–±—А–∞–Ј—Г—О—Й–Є–µ—Б—П –≤ –њ—А–Њ–Є–µ—Б—Б–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤ –Є —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і—Б–≤—П–Ј—Л–≤–∞—О—Й–Є—Е –±–µ–ї–Ї–Њ–≤.
–Я—А–Њ–Є–µ—Б—Б—В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤–Ї–ї—О—З–∞–µ—В –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї —Б —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–∞–Љ–Є –Љ–µ–Љ–±—А–∞–љ —В—А–Њ–Љ–±–Њ–Є–Є—В–Њ–≤, —Н–љ–і–Њ—В–µ–ї–Є—П –Є —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і—Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є –±–µ–ї–Ї–∞–Љ–Є –њ–ї–∞–Ј–Љ—Л. –Р—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞ –Љ–Њ–≥—Г—В –≤—Л—А–∞–±–∞-—В—Л–≤–∞—В—М—Б—П –Ї —А–∞–Ј–ї–Є—З–љ—Л–Љ –Њ—В—А–Є–Є–∞—В–µ–ї—М–љ–Њ –Ј–∞—А—П–ґ–µ–љ–љ—Л–Љ —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–∞–Љ –Љ–µ–Љ–±—А–∞–љ —В—А–Њ–Љ–±–Њ–Є–Є—В–Њ–≤ –Є —Н–љ–і–Њ—В–µ–ї–Є—П - –Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ—Г (–Р–Ъ–Ы),—Д–Њ—Б—Д–∞—В–Є–і–Є–ї–Є–љ–Њ–Ј–Є—В–Њ–ї—Г (–Р–§–Ш),—Д–Њ—Б—Д–∞—В–Є–і–Є–ї—Б–µ—А–Є–љ—Г (–Р–§–°–µ),—Д–Њ—Б—Д–∞—В–Є–і–Є-–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ (–Р–§–Ъ). –С–µ–ї–Ї–Є –њ–ї–∞–Ј–Љ—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–∞–Љ–Є –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ, - –њ—А–Њ—В—А–Њ–Љ–±–Є–љ, —А2-–≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ I, –љ–Є–Ј–Ї–Њ- –Є –≤—Л—Б–Њ–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–є –Ї–Є–љ–Є–љ–Њ–≥–µ–љ—Л –Є —А—П–і –і—А—Г–≥–Є—Е, —Б–ї—Г–ґ–∞—В –Ї–Њ—Д–∞–Ї—В–Њ—А–∞–Љ–Є, –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є –Ї–Њ—В–Њ—А—Л—Е —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і—Л —Б–≤—П–Ј—Л–≤–∞—О—В—Б—П —Б –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞–Љ–Є. –Ю–±–љ–∞—А—Г–ґ–µ–љ–Є–µ –Ї–Њ—Д–∞–Ї—В–Њ—А-–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Р–§–Ы - –љ–∞–Є–±–Њ–ї–µ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–є –њ—А–Є–Ј–љ–∞–Ї –њ—А–Є—З–∞—Б—В–љ–Њ—Б—В–Є –Р–§–Ы –Ї –Р–§–°, —В–Њ–≥–і–∞ –Ї–∞–Ї –Ї–Њ—Д–∞–Ї—В–Њ—А-–љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–µ –Р–§–Ы –Њ—В–љ–Њ—Б—П—В –Ї –љ–µ—Б–њ–µ–Є–Є—Д–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ –Є–љ—Д–µ–Ї–Є–Є–Њ–љ–љ–Њ–≥–Њ–њ—А–Њ–Є–µ—Б—Б–∞. –Ґ–∞–Ї –Р–§–Ы –Љ–Њ–≥—Г—В –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—В—М—Б—П —Г –±–Њ–ї—М–љ—Л—Е —Б–Є—Д–Є–ї–Є—Б–Њ–Љ, –Њ—Б—В—А—Л–Љ–Є –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –≤–Є—А—Г—Б–љ—Л–Љ–Є –Є–љ—Д–µ–Ї–Є–Є—П–Љ–Є. –Т—Л—П–≤–ї—П–µ–Љ—Л–µ –≤ —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –Р–§–Ы –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В —Б–≤—П–Ј–Є —Б —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і-—Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є –±–µ–ї–Ї–∞–Љ–Є. –Э–∞–њ—А–Њ—В–Є–≤, –њ—А–Є –ї–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї–Є–Є–Є–Т–∞—Б–µ—А–Љ–∞–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е, —Б—В—А–∞–і–∞—О—Й–Є—Е —Б–Є—Б—В–µ–Љ–љ—Л–Љ–Є –Є –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–µ –Р–§–Ы, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–Њ–Љ –Є–ї–Є —А2-–≥–ї–Є–Ї–Њ–њ—А–Њ- —В–µ–Є–љ–Њ–Љ I, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± –Є—Е —Б–≤—П–Ј–Є —Б –Р–§–°.
–Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ—А–Њ–Є–µ—Б—Б–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Р–§–Ы –Є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є–≥—А–∞–µ—В —А2-–≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ I. –†2-–У–Я I —Б –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б–Њ–є 50 ^–∞ –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –≤ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –њ–ї–∞–Ј–Љ–µ –≤ –Ї–Њ–љ–Є–µ–љ—В—А–∞–Є–Є–Є –њ—А–Є–Љ–µ—А–љ–Њ 200 –Љ–Ї–≥/–Љ–ї, –Є–Є—А–Ї—Г–ї–Є—А—Г–µ—В –≤ –∞—Б—Б–Њ–Є–Є–∞–Є–Є–Є —Б –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–∞–Љ–Є (–Њ–љ —В–∞–Ї–ґ–µ –Њ–±–Њ–Ј–љ–∞—З–∞–µ—В—Б—П –Ї–∞–Ї –∞–њ–Њ–ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ –Э) –Є –Њ–±–ї–∞–і–∞–µ—В –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О. –Р–љ—В–Є—В–µ–ї–∞, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є–µ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–∞—Е –±–Њ–ї—М–љ—Л—Е –Р–§–°, –љ–∞ —Б–∞–Љ–Њ–Љ –і–µ–ї–µ —А–∞—Б–њ–Њ–Ј–љ–∞—О—В –∞–љ—В–Є–≥–µ–љ–љ—Л–µ –і–µ—В–µ—А–Љ–Є–љ–∞–љ—В—Л –љ–µ –Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ–∞, –∞ –Ї–Њ–љ—Д–Њ—А–Љ–∞–Є–Є–Њ–љ–љ—Л–µ—Н–њ–Є—В–Њ–њ—Л, —Д–Њ—А–Љ–Є—А—Г—О—Й–Є–µ—Б—П –≤ –њ—А–Њ–Є–µ—Б—Б–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –†2-–У–Я I —Б –Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ–Њ–Љ.
–Я—А–Њ–і—Г–Ї—Ж–Є—П –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Ї –њ—А–Њ—В—А–Њ–Љ–±–Є–љ—Г —В–µ—Б–љ–Њ —Б–≤—П–Ј–∞–љ–∞ —Б –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є —В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П. –Р—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞ –Ї —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і-—Б–≤—П–Ј–∞–љ–љ—Л–Љ –±–µ–ї–Ї–∞–Љ –Љ–Њ–≥—Г—В –≤—Л—П–≤–ї—П—В—М—Б—П –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–Њ—З–µ—В–∞–љ–Є—П—Е: –∞–љ—В–Є—В–µ–ї–∞ –Ї –њ—А–Њ—В—А–Њ–Љ–±–Є–љ—Г, –њ—А–Њ—В–µ–Є–љ—Г –°, –†2-–У–Я I, —В—А–Њ–Љ–±–Њ–Љ–Њ–і—Г–ї–Є–љ—Г –Є–ї–Є –∞–љ—В–Є—В–µ–ї–∞ –Ї –Њ–і–љ–Њ–Љ—Г –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є–Љ –њ—А–Њ—В–µ–Є–љ–∞–Љ. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ –∞–Ї—В–Є–≤–∞–Є–Є—П—В—А–Њ–Љ–±–Њ–Є–Є—В–Њ–≤ –Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —Н–љ–і–Њ—В–µ–ї–Є—П –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї —Б –±–µ–ї–Ї–∞–Љ–Є —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤ –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–Є. –Я—А–Є —Н—В–Њ–Љ –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –Ї —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–∞–Љ –Љ–µ–Љ–±—А–∞–љ —В—А–Њ–Љ–±–Њ–Є–Є—В–Њ–≤ –Є —Н–љ–і–Њ—В–µ–ї–Є—П –≤—Л–њ–Њ–ї–љ—П—О—В —Д—Г–љ–Ї–Є–Є—О —В—А–Є–≥–≥–µ—А–Њ–≤ –њ—А–Є –∞–Ї—В–Є–≤–∞–Є–Є–Є –Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–Є –Ї–ї–µ—В–Њ–Ї. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –∞–љ—В–Є—В–µ–ї–∞ –Ї –њ—А–Њ—В—А–Њ–Љ–±–Є–љ—Г (—Д–∞–Ї—В–Њ—А—Г II —Б–≤—С—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є) —Б–≤—П–Ј—Л–≤–∞—О—В—Б—П —Б —В—А–Њ–Љ–±–Њ–Є–Є—В–∞–Љ–Є, –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є —В—А–Њ–Љ–±–Є–љ–Њ–Љ, –Є –Є–љ–≥–Є–±–Є-—А—Г—О—В –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –њ—А–Њ—Б—В–∞–Є–Є–Ї–ї–Є–љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–µ–Љ. –Т—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –∞–љ—В–Є—В–µ–ї –Ї –њ—А–Њ—В—А–Њ–Љ–±–Є–љ—Г —Б–≤—П–Ј–∞–љ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –≤ –≤–µ–љ–Њ–Ј–љ–Њ–Љ —А—Г—Б–ї–µ, —Н–Љ–±–Њ–ї–Є–µ–є –ї–µ–≥–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є –Є –Є–љ—Д–∞—А–Ї—В–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–∞.
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Р–§–° –і–Њ –љ–µ–і–∞–≤–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –±—Л–ї–∞ –Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –≤–Њ–ї—З–∞–љ–Њ—З–љ–Њ-–≥–Њ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ —Б –њ–Њ–Љ–Њ—Й—М—О —Д—Г–љ–Ї–Є–Є–Њ–љ–∞–ї—М–љ—Л—Е —В–µ—Б—В–Њ–≤ –Є –∞–љ—В–Є—В–µ–ї –Ї –Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ—Г —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ—Д–µ—А–Љ–µ–љ—В–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞. –Ґ–µ—А–Љ–Є–љ ¬Ђ–≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В¬ї –Њ–±–Њ–Ј–љ–∞—З–∞–µ—В –∞–љ—В–Є—В–µ–ї–∞, –Ї–Њ—В–Њ—А—Л–µ, —Б–≤—П–Ј—Л–≤–∞—П—Б—Мinvitro—Б —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–∞–Љ–Є, —Г–і–ї–Є–љ—П—О—В —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і-–Ј–∞–≤–Є—Б–Є–Љ—Л–µ —В–µ—Б—В—Л –Ї–Њ–∞–≥—Г–ї—П–Є–Є–Є (–љ–∞–њ—А–Є–Љ–µ—А, –Ї–Њ–љ–≤–µ—А—Б–Є—О –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–∞ –≤ —В—А–Њ–Љ–±–Є–љ).
–°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –Т–Р –Њ–±–ї–∞–і–∞–µ—В –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є —Б–њ–µ–Є–Є—Д–Є—З–љ–Њ—Б—В—М—О, –∞ –Р–Ъ–Ы - –±–Њ–ї—М—И–µ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Р–§–°. –Ю–і–љ–∞–Ї–Њ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–Ї—А–Є–љ–Є–љ–≥–Њ–≤—Л—Е —В–µ—Б—В-—Б–Є—Б—В–µ–Љ –њ–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—О –Р–§–Ы –Ї –і—А—Г–≥–Є–Љ —А–∞–Ј–ї–Є—З–љ—Л–Љ —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–∞–Љ (—Д–Њ—Б—Д–∞—В–Є–і–Є–ї—Б–µ—А–Є–љ—Г, —Д–Њ—Б—Д–∞—В–Є–і–Є–ї–Є–љ–Њ–Ј–Є—В–Њ–ї—Г, —Д–Њ—Б—Д–∞—В–Є–і–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ), –∞ –љ–µ —В–Њ–ї—М–Ї–Њ –Ї –Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ—Г, —Б–њ–µ–Є–Є—Д–Є—З–љ–Њ—Б—В—М –Ї –Р–§–Ы —А–µ–Ј–Ї–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В. –Ґ–∞–Ї, —Б –њ–Њ–Љ–Њ—Й—М—О —Б–Ї—А–Є–љ–Є–љ–≥–Њ–≤–Њ–≥–Њ —В–µ—Б—В–∞ –±—Л–ї–∞ –Њ—В–Љ–µ—З–µ–љ–∞ —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –љ–∞–ї–Є—З–Є–µ–Љ IgG–Р–§–Ы –Є —А–∞–Ј–≤–Є—В–Є–µ–Љ —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г –њ–∞–Є–Є–µ–љ—В–Њ–≤; –љ–∞—Е–Њ–ґ–і–µ–љ–Є–µ–Љ IgG–Р–§–Ъ, IgG–Р–§–Ш, IgG–Р–§–°–µ –Є —В—А–Њ–Љ–±–Њ–Є–Є—В–Њ–њ–µ–љ–Є–µ–є. –Э–µ–і–∞–≤–љ–Њ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–∞—Е –њ–∞–Є–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ 60% –Њ–±—А–∞–Ј–Є–Њ–≤ —Б–Њ–і–µ—А–ґ–∞—В –∞–љ—В–Є—В–µ–ї–∞ –Ї —А–∞–Ј–ї–Є—З–љ—Л–Љ —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–∞–Љ, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –∞–љ—В–Є—В–µ–ї –Ї –Ъ–Ы.
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –њ–Њ—П–≤–Є–ї–Є—Б—М –і–∞–љ–љ—Л–µ, —Г–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ –љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Є—П –њ–Њ–ї–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л—Е –∞–љ—В–Є—В–µ–ї —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –≥–µ—Б—В–Њ–Ј–Њ–Љ. –Я–Њ –і–∞–љ–љ—Л–Љ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 15 –ї–µ—В, –≥–µ—Б—В–Њ–Ј —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –љ–∞—А—Г—И–µ–љ–љ–Њ–є –њ–ї–∞–Є–µ–љ—В–∞–Є–Є–µ–є, —Г–Љ–µ–љ—М—И–µ–љ–љ–Њ–є –њ–µ—А—Д—Г–Ј–Є–µ–є –њ–ї–∞–Є–µ–љ—В—Л, –і–Є—Б—Д—Г–љ–Ї–Є–Є–µ–є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є —Б–Є—Б—В–µ–Љ–љ—Л–Љ –≤–∞–Ј–Њ—Б–њ–∞–Ј–Љ–Њ–Љ. –У–µ—Б—В–Њ–Ј –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Р–§–Ы —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —В—П–ґ–µ–ї—Л–Љ –Є –∞—В–Є–њ–Є—З–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ, –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤ –Ї–Њ–љ–Є–µII-–љ–∞—З–∞–ї–µ III —В—А–Є–Љ–µ—Б—В—А–∞, —А–∞–љ–љ–Є–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ –∞—Б—Б–Є–Љ–µ—В—А–Є—З–љ–Њ–є —Д–Њ—А–Љ—Л –Ј–∞–і–µ—А–ґ–Ї–Є –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –њ–ї–Њ–і–∞.
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –њ—А–Є –≥–µ—Б—В–Њ–Ј–µ –Є –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–є –≥–Є–њ–Њ—В—А–Њ—Д–Є–Є –њ–ї–Њ–і–∞ –≤—Б—В—А–µ—З–∞—О—В—Б—П –Р–§–Ы –Ї –Ъ–Ы (IgM- 46%, IgG- 22%), –§–°–µ(IgM- 37%, IgG- 16%) –Є –§–• (IgM- 41%, IgG- 23%). –£—А–Њ–≤–µ–љ—М –Р–§–Ы –њ—А–Є –≥–µ—Б—В–Њ–Ј–µ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б —В—П–ґ–µ—Б—В—М—О –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Т—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Р–§–Ы –≤ I —В—А–Є–Љ–µ—Б—В—А–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —П–≤–ї—П–µ—В—Б—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —В—П–ґ–µ–ї–Њ–≥–Њ –≥–µ—Б—В–Њ–Ј–∞ –Є/–Є–ї–Є –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–є –≥–Є–њ–Њ—В—А–Њ—Д–Є–Є –њ–ї–Њ–і–∞.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞ –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–Ї—А–Є-–љ–Є–љ–≥–Њ–≤—Л—Е —В–µ—Б—В-—Б–Є—Б—В–µ–Љ, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е –Њ–њ—А–µ–і–µ–ї—П—В—М —Б—Г–Љ–Љ–∞—А–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –∞–љ—В–Є—В–µ–ї –Ї –Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ—Г, —Д–Њ—Б—Д–∞—В–Є–і–Є–ї-—Б–µ—А–Є–љ—Г, —Д–Њ—Б—Д–∞—В–Є–і–Є–ї-–Є–љ–Њ–Ј–Є—В–Њ–ї—Г –Є —Д–Њ—Б—Д–∞—В–Є–і–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ, –∞ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ, –µ—Б–ї–Є –љ–µ-–Њ–±—Е–Њ–і–Є–Љ–Њ, –±–Њ–ї–µ–µ –і–µ—В–∞–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ—Л—Е –Р–§–Ы.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є
–•—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–є –≥–∞—Б—В—А–Є—В –Є –њ–µ—А–љ–Є—Ж–Є–Њ–Ј–љ–∞—П –∞–љ–µ–Љ–Є—П —З–∞—Б—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –∞—Г-—В–Њ–∞–љ—В–Є—В–µ–ї –њ—А–Њ—В–Є–≤ –њ–∞—А–Є–µ—В–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –ґ–µ–ї—Г–і–Ї–∞. –Р–љ—В–Є—В–µ–ї–∞ –Ї –њ–∞—А–Є–µ—В–∞–ї—М–љ—Л–Љ –Ї–ї–µ—В–Ї–∞–Љ –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В –њ—А–Є–Љ–µ—А–љ–Њ —Г 90% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–µ—А–љ–Є—Ж–Є–Њ–Ј–љ–Њ–є –∞–љ–µ–Љ–Є–µ–є, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ –≥–∞—Б—В—А–Є—В–Њ–Љ –±–µ–Ј –њ–µ—А–љ–Є—Ж–Є–Њ–Ј–љ–Њ–є –∞–љ–µ–Љ–Є–Є - –і–Њ 50% –Є —Г 33% –±–Њ–ї—М–љ—Л—Е —В–Є—А–µ–Њ–Є–і–Є—В–Њ–Љ. –Ф–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П —Ж–µ–љ–љ–Њ—Б—В—М —В–µ—Б—В–Њ–≤, –і–µ—В–µ–Ї—В–Є—А—Г—О—Й–Є—Е —Н—В–Є –∞–љ—В–Є—В–µ–ї–∞, —Б–Њ—Б—В–Њ–Є—В –≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Є—Е –і–ї—П —Б–Ї—А–Є–љ–Є–љ–≥–∞ –±–Њ–ї—М–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е –≤—Л—П–≤–ї–µ–љ–∞ –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М –Ї –њ–µ—А–љ–Є—Ж–Є–Њ–Ј–љ–Њ–є –∞–љ–µ–Љ–Є–Є (–ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–∞—П –∞–љ–µ–Љ–Є—П, —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–µ —А–∞—Б-—В—А–Њ–є—Б—В–≤–∞, —Б–Є–љ–і—А–Њ–Љ –®–µ–≥—А–µ–љ–∞).
–Р–љ—В–Є–Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞ (–Р–Ь–Р) - –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–∞—П –≥—А—Г–њ–њ–∞ –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –њ—А–Њ—В–Є–≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –±–µ–ї–Ї–Њ–≤, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –љ–∞ –≤–љ—Г—В—А–µ–љ–љ–µ–є –Є –љ–∞—А—Г–ґ–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ–∞—Е –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є. –Р–љ—В–Є–Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞ –Ь2 –Є–Љ–µ—О—В –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –±–Є–ї–Є–∞—А–љ–Њ–≥–Њ —Ж–Є—А—А–Њ–Ј–∞ - —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ј–∞–±–Њ–ї–µk–≤–∞–љ–Є—П –њ–µ—З–µ–љ–Є, –њ—А–Њ—В–µ–Ї–∞—О—Й–µ–≥–Њ —Б –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ–Љ –Є –Њ–±—Б—В—А—Г–Ї—Ж–Є–µ–є –≤–љ—Г—В—А–Є–њ–µ—З—С–љ–Њ—З–љ—Л—Е –ґ–µ–ї—З–љ—Л—Е –њ—А–Њ—В–Њ–Ї–Њ–≤, —Ж–Є—А—А–Њ–Ј–Њ–Љ –Є —А–∞–Ј–≤–Є—В–Є–µ–Љ –њ–µ—З—С–љ–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є.
–Ъ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ HLA-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є—П–Љ –Њ—В–љ–Њ—Б–Є—В—Б—П —Ж–µ–ї–Є–∞–Ї–Є—П, –Є–Ј–≤–µ—Б—В–љ–∞—П –Ї–∞–Ї –≥–ї—О—В–µ–љ- —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–∞—П —Н–љ—В–µ—А–Њ–њ–∞—В–Є—П, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–∞—П—Б—П –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ —В–Њ–љ–Ї–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞, –і–Є–∞—А–µ–µ–є, –њ–Њ—В–µ—А–µ–є –≤–µ—Б–∞ –Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –њ–Є—В–∞–љ–Є—П. –Я—А–Є—З–Є–љ–Њ–є —Н—В–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є —П–≤–ї—П–µ—В—Б—П –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –≤ –Њ—В–≤–µ—В –љ–∞ –≥–ї–Є–∞–і–Є–љ - –±–µ–ї–Њ–Ї, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є–є –≤–Њ –Љ–љ–Њ–≥–Є—Е –Ј–µ—А–љ–Њ–≤—Л—Е –њ—А–Њ–і—Г–Ї—В–∞—Е. –£ –Љ–љ–Њ–≥–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞–±–ї—О–і–∞—О—В—Б—П –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –Є–ї–Є –≤—А–µ–Љ–µ–љ–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л, –њ–Њ—Н—В–Њ–Љ—Г –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Ј–∞—В—А—Г–і–љ–µ–љ–∞. –£—З–Є—В—Л–≤–∞—П –±–Њ–ї—М—И—Г—О —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М —Ж–µ–ї–Є–∞–Ї–Є–Є –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –≤ —Ж–µ–ї–Њ–Љ –Є –Њ–≥—А–Њ–Љ–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –±–Њ–ї—М–љ—Л—Е —Ж–µ–ї–Є–∞–Ї–Є—П-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —В–∞–Ї–Є–Љ–Є –Ї–∞–Ї –Є–љ—Б—Г–ї–Є–љ–Ј–∞–≤–Є—Б–Є–Љ—Л–є —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В, –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј, –∞–љ–µ–Љ–Є—П, —А–∞–Ј–ї–Є—З–љ—Л–µ –і–µ—Д–µ–Ї—В—Л —А–∞–Ј–≤–Є—В–Є—П, —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П, –Љ–Њ–ґ–љ–Њ –≥–Њ–≤–Њ—А–Є—В—М –Њ –≤—Л—Б–Њ–Ї–Њ–є —Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Ж–µ–ї–Є–∞–Ї–Є–Є. –†–Є—Б–Ї –Є–љ—В–µ—Б-—В–Є–љ–∞–ї—М–љ–Њ–є–ї–Є–Љ—Д–Њ–Љ—Л –Є –і—А—Г–≥–Є—Е –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л—Е –љ–µ–Њ–њ–ї–∞–Ј–Љ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В, –µ—Б–ї–Є –±–Њ–ї–µ–Ј–љ—М –љ–µ –ї–µ—З–Є—В—Б—П. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ–ї–µ—З–µ–љ–∞—П —Ж–µ–ї–Є–∞–Ї–Є—П, –і–∞–ґ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –љ–µ–≤—Л—А–∞–ґ–µ–љ–љ–∞—П, –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞–µ—В –Ї –і—А—Г–≥–Є–Љ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ.
–£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –љ–µ–ї–µ—З–µ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є –Ї—А–Њ–≤–Є –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞ –њ—А–Њ—В–Є–≤ –≥–ї–Є–∞–і–Є–љ–∞. –Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ IgA–Є IgG–∞–љ—В–Є—В–µ–ї –њ—А–Њ—В–Є–≤ –≥–ї–Є–∞–і–Є–љ–∞ –Є–Љ–µ–µ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Ж–µ–ї–Є–∞–Ї–Є–µ–є. –Ф–ї—П –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ–≥–Њ –і–Є–∞–≥–љ–Њ–Ј–∞ —Ж–µ–ї–Є–∞–Ї–Є–Є –њ–Њ—Б–ї–µ –њ–Њ–ї—Г—З–µ–љ–Є—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞ –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –∞–љ—В–Є—В–µ–ї –њ—А–Њ—В–Є–≤ –≥–ї–Є–∞–і–Є–љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ј—П—В–Њ–≥–Њ –Є–Ј –Љ–µ—Б—В–∞ –њ–Њ—А–∞–ґ–µ–љ–Є—П –±–Є–Њ–њ—В–∞—В–∞ –Є –≤—Л—П–≤–ї–µ–љ–Є–µ –∞—В—А–Њ—Д–Є–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є. –Ш—Б–Ї–ї—О—З–Є—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –±–Є–Њ–њ—Б–Є–Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –∞–љ—В–Є—В–µ–ї –Ї —В–Ї–∞–љ–µ–≤–Њ–є —В—А–∞–љ—Б–≥–ї—Г—В–∞–Љ–Є-–љ–∞–Ј–µ(tTG)- –љ–Њ–≤–Њ–Љ—Г –≤—Л—Б–Њ–Ї–Њ—Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ–Љ—Г –Љ–∞—А–Ї–µ—А—Г —Ж–µ–ї–Є–∞–Ї–Є–Є. –Ґ–Ї–∞–љ–µ–≤–∞—П —В—А–∞–љ—Б–≥–ї—Г—В–∞–Љ–Є–љ–∞–Ј–∞ –±—Л–ї–∞ –Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–∞ –≤ 1997 –≥–Њ–і—Г –Ї–∞–Ї –≥–ї–∞–≤–љ—Л–є, –µ—Б–ї–Є –љ–µ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–є —Н–љ–і–Њ–Љ–Є–Ј–Є–∞–ї—М–љ—Л–є–∞—Г—В–Њ–∞–љ—В–Є–≥–µ–љ –њ—А–Є —Ж–µ–ї–Є–∞–Ї–Є–Є. –≠—В–Њ—В —Д–µ—А–Љ–µ–љ—В —Б–Є–љ—В–µ–Ј–Є—А—Г–µ—В—Б—П —И–Є—А–Њ–Ї–Є–Љ —Б–њ–µ–Ї—В—А–Њ–Љ –Ї–ї–µ—В–Њ–Ї —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ —В–Є–њ–∞ –Є –Њ–±—Л—З–љ–Њ –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–Љ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ. tTG –њ–Њ—В—А–µ–±–ї—П–µ—В—Б—П –Ї–ї–µ—В–Ї–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ —Г—З–∞—Б—В–≤—Г—О—В –≤ —В–Ї–∞–љ–µ–≤–Њ–є —А–µ–њ–∞—А–∞—Ж–Є–Є, –Є –Є–љ–Є—Ж–Є–Є—А—Г–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –њ–Њ–њ–µ—А–µ—З–љ—Л—Е —Б–≤—П–Ј–µ–є –Љ–µ–ґ–і—Г —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ—Л–Љ–Є –±–µ–ї–Ї–∞–Љ–Є. tTG–∞–Ї—В–Є–≤–Є—А—Г–µ—В —В—А–∞–љ—Б—Д–Њ—А–Љ–Є—А—Г—О—Й–Є–є —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ —А, –Ї–Њ—В–Њ—А—Л–є –Є–Ј–Љ–µ–љ—П–µ—В –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤—Л–є —Б–Є–љ—В–µ–Ј –Є –Є–љ–і—Г—Ж–Є—А—Г–µ—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–ї–Є–Ј–Є—Б—В–Њ–є –Ї–Є—И–µ—З–љ–Є–Ї–∞.
–Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –µ—Б–ї–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –∞–љ—В–Є—В–µ–ї –Ї –≥–ї–Є–∞–і–Є–љ—Г –≤ –Ї—А–Њ–≤–Є —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–∞, —В–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –∞–љ—В–Є—В–µ–ї –Ї tTG –Њ—Б—В–∞–µ—В—Б—П –љ–∞ –њ–Њ—Б—В–Њ—П–љ–љ–Њ–Љ —Г—А–Њ–≤–љ–µ. –Я–Њ—Н—В–Њ–Љ—Г –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –∞–љ—В–Є—В–µ–ї –Ї tTG—П–≤–ї—П–µ—В—Б—П –њ—А–µ–Ї—А–∞—Б–љ—Л–Љ –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–Љ –і–ї—П —Б–Ї—А–Є–љ–Є–љ–≥–∞ –љ–∞—Б–µ–ї–µ–љ–Є—П –љ–∞ –≤—Л—П–≤–ї–µ–љ–Є–µ –і–Њ —Б–Є—Е –њ–Њ—А –µ—Й–µ –њ–ї–Њ—Е–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ–Љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –∞ —В–∞–Ї–ґ–µ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –Ї–Њ–љ—В—А–Њ–ї—П –ї–µ—З–µ–љ–Є—П —Ж–µ–ї–Є–∞–Ї–Є–Є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є–≤–µ–і–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –і–µ–Ш—Б—В–≤–Є—В–µ–ї—М–љ–Њ —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є—П –ї–∞-–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–Љ–µ–µ—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —И–Є—А–Њ–Ї–Є–Ш —Б–њ–µ–Ї—В—А —В–µ—Б—В-—Б–Є—Б—В–µ–Љ, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е —Б –≤—Л—Б–Њ–Ї–Њ–є —Б—В–µ–њ–µ–љ—М—О –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є –Є –Є–љ-—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ—Б—В–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М —А–∞–љ–љ—О—О –Є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–≤–Њ–і–Є—В—М –Њ—Ж–µ–љ–Ї—Г –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.
|




